
跟人体其它组织器官一样,大脑神经也会“发炎”。细菌、病毒甚至衰老都有可能引发免疫系统的反应,导致脑神经炎症,进而引发神经功能的退化。科学家们发现,在很多脑炎疾病中常常伴有肌肉功能的下降,而它们之间的关系尚不十分明确。
近日,一项最新研究揭示了神经炎症与肌肉功能退化之间的深层联系。这项题为《感染与慢性疾病激活系统性脑-肌信号轴》(“Infection and Chronic Disease Activate a Systemic Brain-muscle Signaling Axis”)的研究于2024年7月12日发表于《科学·免疫学》(Science Immunology)杂志上,作者是来自复旦大学生命科学学院的杨烁团队。
通过研究大肠杆菌、新型冠状病毒(SARS-CoV-2)以及阿尔兹海默病(AD)在果蝇和小鼠模型中所引发的神经炎症和肌肉退化,该研究发现所有这些疾病都激活了一条调节肌肉表现的“大脑-肌肉信号轴”,其中炎症等多种应激因素导致Upd3(Unpaired3)/IL-6(白细胞介素-6)细胞因子被激活,并进一步激活骨骼肌中的JAK-STAT信号通路(Janus激酶-信号转导和转录激活因子),调节线粒体功能,最后影响肌肉功能。
“细胞因子”是一类小分子蛋白质,它们就像“信使”一样,通过与细胞表面受体结合来传达“命令”,促进或者抑制细胞的分化、增殖等行为。“器官通过分泌分子进行通讯,这些分子进入循环系统,转移到目标组织,导致包括免疫、行为、神经发生、心血管功能、细胞老化等种种后果。”研究写道。
人们通常认为是神经炎症所引发的神经功能变化直接导致了肌肉功能下降等等外部症状,而该研究从器官间通讯的角度揭示了另一种具有普遍性的机制。
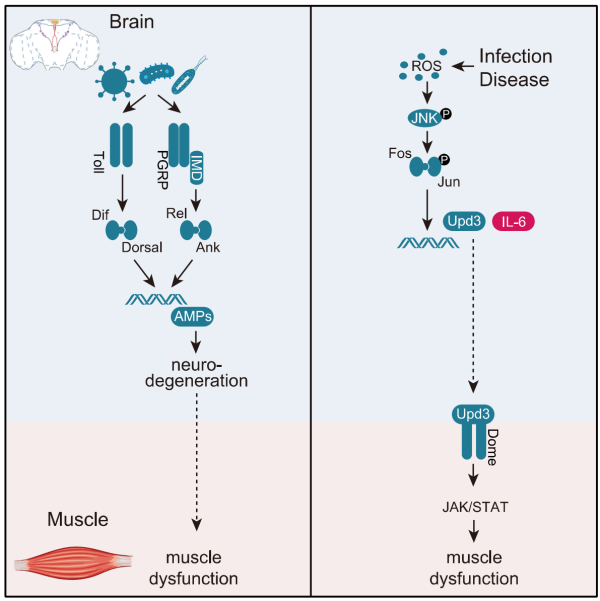 传统观点(左图)认为,由感染导致的神经炎症产生炎症因子,导致神经元凋亡,进而直接影响对肌肉的控制。该研究(右图)则发现了一条大脑和肌肉之间通过细胞因子通讯从而调节肌肉功能的机制。受访者供图。
传统观点(左图)认为,由感染导致的神经炎症产生炎症因子,导致神经元凋亡,进而直接影响对肌肉的控制。该研究(右图)则发现了一条大脑和肌肉之间通过细胞因子通讯从而调节肌肉功能的机制。受访者供图。
研究人员是怎样通过果蝇和小鼠模型进行研究的?细菌、病毒、阿尔兹海默病等神经退行性疾病所导致的肌肉功能衰退本质一样吗?这种衰退能够逆转吗?该研究对治疗大脑/肌肉疾病有何意义?为了回答这些问题,澎湃科技于近日采访了该研究的第一作者、复旦大学生命科学学院研究员杨烁。
【对话】
澎湃科技:能否介绍一下自己以及团队?你是缘何开展这项研究的?
杨烁(复旦大学生命科学学院研究项目负责人,博导):我在2023年2月入职复旦大学生命科学学院,研究方向主要集中于信号跨器官传递、肌肉形态发生以及运动系统遗传病等领域,以第一作者和通讯作者身份在Cell Host&Microbe, Science Immunology, Nature Communications, Development, JCI insight(斜体)等期刊发表多篇论文。实验室目前主要关注于三个方向:第一,探索多器官互作网络在整体稳态中的功能和机制;第二,筛选针对阿尔茨海默症的运动保护性因子;第三,建立运动系统相关遗传病的动物模型。
之前在美国华盛顿大学做博后时,我跟合作导师Aaron Johnson教授一直关注于肌肉系统的发育机制和相关肌病。在COVID-19流行期间,即2021年初,我们发现身边的同事,在新冠康复之后,经常伴随有焦虑等神经系统症状,以及肌无力等肌肉系统症状。这个事情引起了我们的兴趣。
我们发现,多种疾病,包括细菌性脑炎、病毒性脑炎和神经退行性疾病,患者均呈现出大脑/肌肉的双重症状。2020年,我们刚发表于发育生物学经典期刊Development上的研究表明,外胚层(发育为表皮和神经组织等)可以通过分泌FGF信号通路的配体,调控中胚层(发育为肌肉)肌肉细胞FGF通路的平衡,从而操控形态发生和器官构建。因此,我们猜测,与之相似,脑炎是否会改变大脑的分泌谱,从而通过分泌性蛋白直接调控肌肉的生理功能呢?
 如同希腊神话中的擎天神阿特拉斯托起苍天,神经炎症让人们的肌肉不堪重负。受访者供图。
如同希腊神话中的擎天神阿特拉斯托起苍天,神经炎症让人们的肌肉不堪重负。受访者供图。
澎湃科技:什么是神经炎症?既然炎症是由免疫系统对机体做出的“保护”而引起,为什么反而会对机体造成伤害?
杨烁:抗击外界感染是免疫系统的核心功能。免疫系统可以通过吞噬病原,释放炎性因子杀伤病原以及产生抗体阻止病原对细胞的侵入等多种方式应对感染。但免疫系统的过度激活,会造成白细胞介素、TNF-a, 补体蛋白分子等炎性因子的大量释放,对感染源及被感染的细胞进行暴风雨般的自杀式攻击,造成自身组织细胞的旁观者损伤伴随血管通透性增加及循环障碍,甚至会导致多器官功能衰竭(MOF)。很多新冠重症患者的死亡原因就是源于此。因此,免疫系统的受控激活和抑制,是人体维持正常功能的必然要求。
澎湃科技:什么是器官间通信?近几十年种生物学中有一些类似视角涌现,如“脑-肠轴”,能否介绍一下这一思路的背景和发展?
杨烁:从单细胞动物发展到多细胞动物,是动物进化史上的一个飞跃。从多细胞动物开始,动物身体的各个部分为适应外界环境而逐渐分化为具有特定功能的器官。经典理论认为,各器官的功能受到内分泌系统和神经系统的调控。
而近些年的研究发现,除了神经/激素调控之外,不同器官之间可通过代谢小分子和非激素类分泌性蛋白实现相互调控,这种调控机制被称为信号的跨器官传递(Inter-organ communication networks, ICN)。ICN可以主动/被动响应多种病理变化,参与调控并维持机体器官正常生理功能和整体稳态。例如,ICN异常与心脏瓣膜病、非酒精性脂肪肝、慢性肾炎等多种疾病的发生息息相关。
目前,特别受关注的器官交流除了“脑肠轴”之外,还有大脑和肌肉细胞构成器官的交流。7月22日,《细胞》(Cell)发表了题为Innate immune memory after brain injury drives inflammatory cardiac dysfunction,以及7月12日《自然·心血管研究》(Nature Cardiovascular Research)上发表的题为Reward system activation improves recovery from acute myocardial infarction的研究,均表明了大脑对心脏的调控作用。5月3日,《科学》(Science)刊发了题为Brain-muscle communication prevents muscle aging by maintaining daily physiology,表明了中枢神经系统生物钟,可以通过未知的方式调节骨骼肌功能。
因此,进一步解析ICN,不仅可以增强我们对生命体器官间调控网络的认知,更可以为介入治疗系统性炎症风暴、神经损伤、肌无力等ICN相关疾病提供依据。
澎湃科技:文章探究了大肠杆菌、新冠病毒和阿尔兹海默病所导致的神经炎症所引发的脑肌通讯机制。为什么选择这三种情况?
杨烁:因为我们从日常生活和文献检索中发现,这三种情况涵盖了我们能接触到的绝大多数大脑/肌肉双重病症的人群。
澎湃科技:研究主要选取了黑腹果蝇作为模型来研究大脑到肌肉的通讯。这些模型是如何构建的?果蝇也能“得”新冠和老年痴呆吗?昆虫的肌肉功能调节跟人类的相似性和不同点在哪里?研究中还采用了小鼠模型,是出于什么考虑?
杨烁:果蝇并不能患老年痴呆。目前对于老年痴呆的病因解释多样,但大多数人接受淀粉样beta蛋白(Amyloid beta)和tau蛋白成因说,即这些蛋白质在脑内异常积聚引起了疾病。因此,在动物模型中,我们一般通过在大脑中表达人类Amyloid beta 42蛋白,来构建老年痴呆模型。
新冠病毒通过结合ACE2受体侵入细胞,果蝇虽然具有ACE2受体的同源蛋白(Nature,2002 Jun 20;417(6891):822-8),但新冠病毒并不能直接感染果蝇细胞。因此,我们通过遗传学的方式,在果蝇体内特异性表达新冠病毒的毒力蛋白,例如NSP1等,来探索病毒毒力蛋白对机体的影响。这种研究方式的优势是,可以利用果蝇丰富的遗传学工具,加快研究进度。
昆虫跟人类一样,具有骨骼肌,平滑肌和心肌。其肌肉系统在分子和细胞层面上跟人类高度保守,因而是研究肌肉系统发育、功能和相关疾病的良好模式动物。
我们之所以采用小鼠模型,是因为昆虫毕竟不是哺乳动物,其和人类的差距较大,因而,在同为哺乳动物的小鼠中验证在果蝇里的发现,对于证明该研究的物种保守型,是必须的。
澎湃科技:研究发现在三种神经炎症类型中都发现了一种信号模式,其中细胞外配体Upd3在中枢神经系统中对活性氧进行响应,并诱导骨骼肌JAK-STAT信号,导致线粒体功能障碍以及运动功能降低。能否为我们通俗地解释一下这个过程?
杨烁:线粒体是能量代谢的核心,而肌肉是能量消耗大户。线粒体功能的紊乱,必然会导致产能降低,因而肌肉会缺乏能量供应,从而无法正常发挥功能。
澎湃科技:在人类患者中,这三种疾病导致的运动功能障碍似乎表现并不相同。该研究发现的机制在三种疾病中的呈现完全一样吗?它是这些疾病肌肉功能减退的主因吗?
杨烁:从细胞生物学层面来看,三种疾病都会通过影响肌肉线粒体膜电位而致病,因而其致病机制是完全一样的。
是否是肌肉功能减退的主要原因,目前无法给出结果。我们只能证明,其在肌肉失能中起到重要作用,但其作用到底占比多少,无法给出结论。
澎湃科技:该过程所导致的肌肉功能衰退是可逆的吗?在疾病治愈后它会消失吗?
杨烁:是的,我们的实验证明,该衰退是可逆的,肌肉会逐步恢复正常功能。
澎湃科技:新冠长期后遗症(Long covid)是很多人关心的话题,研究有什么发现?认知下降与运动功能下降是必然的结果吗?
杨烁:我们发现神经感染是造成长新冠的原因之一。但大脑/肌肉双重病症并不会发生在每一个患者之中。
澎湃科技:在一些肠-脑轴的研究中,人们发现通过调节菌群构成能够反过来影响神经系统。您认为该研究中所呈现的脑-肌轴有可能是双向的吗?
杨烁:这是一个很好的问题,目前我们正在进行的研究就是,运动能否诱发某些肌肉因子的分泌,而这些肌肉因子可以进入循环系统,穿透血脑屏障,从而抑制阿尔茨海默症的发生。目前鸢尾素是最热门的肌肉来源的神经保护蛋白,但因为其影响代谢,因而在应用中出现了很多问题。我们想通过遗传学模型筛选更多运动保护因子,从而人工模拟运动效果,延缓阿尔茨海默症的发生时间,以及减轻其进程。
澎湃科技:该研究在药物开发和疾病诊断和治疗方面的前景?
杨烁:我们找到的Upd3/IL-6分子,已经上市的针对其的中和抗体和相关通路抑制剂已经有很多。因而,我们的研究为拓展这些药物的适应症,提出了科学的依据。
转载来源:澎湃新闻 作者:季敬杰

 京公网安备 11010802028547号
京公网安备 11010802028547号