
在2024ASCO上,荣昌生物披露了RC88的首次人体Ⅰ/Ⅱ期临床数据。
在卵巢癌(OC)队列中,截至2024年3月22日,2.0mg/kg组共有31例患者接受了2至4线既往治疗,可进行疗效评估。其中ORR为45.2%(cORR41.9%),中位DoR为8.02个月。
在非鳞状非小细胞肺癌(NSCLC)队列中,16例可评估患者的ORR为31.3%(cORR25%),其中MSLN高表达患者的ORR、cORR、中位PFS和中位DoR分别为41.7%、33.3%、6.87个月和9.13个月。
在宫颈癌(CC)队列中,18例可评估患者的ORR为33.3%(cORR27.8%)。在接受≥2线治疗的12例患者中,ORR为41.7%(cORR33.3%)。
目前,铂耐药卵巢癌标准治疗方案化疗的ORR为12%,这项研究的ORR为45.2%(cORR41.9%),令人鼓舞的结果显示了RC88在显著改善MSLN表达的晚期实体瘤患者预后方面的潜力。
RC88在ASCO的精彩亮相有望吸引MNC的目光,鉴于MSLNADC布局的企业较少,期待RC88的授权。
新抗癌“明星”靶点
间皮素基因(MSLN)位于染色体16p13.3,其基因全长8kb,cDNA大小为213bp,17个外显子,编码628个氨基酸。MSLN基因编码一个71KD的前体蛋白。该前体蛋白可被弗林(furin)蛋白酶水解为两个部分:其中一个片段为间皮素(MSLN),分子量为40kDa,通过糖基磷脂酰肌醇锚定在细胞膜表面;另一个片段为巨核细胞集落刺激因子(MPF),分子量为31kDa,可被释放入血或进一步稀释。
MSLN在恶性间皮瘤、胰腺癌、卵巢癌等恶性肿瘤中呈现高表达。在健康组织中,MSLN表达有限,仅表达于胸膜、腹膜和心包的正常间皮细胞,但在恶性间皮瘤、卵巢癌、胰腺癌等恶性肿瘤中高表达,与癌细胞的增殖,局部侵袭、转移和抗凋亡关系密切。具体而言,MSLN被发现表达于90%的间皮瘤、80%~85%的胰腺癌、60%~65%的卵巢癌、60%~65%的肺癌等。
整体而言,MSLN由于在正常组织中表达有限,在多种恶性肿瘤中过表达,因此是靶向治疗的理想候选。
多种打法齐上阵:ADC、CAR-T、多抗
目前针对MSLN靶点在研的药物类型包括CAR-T/TCR-T细胞疗法、抗体类药物、抗体偶联药物(ADC)、癌症疫苗等。
(1)ADC药物
作为至今还没有任何药物上市且最高仍在II期阶段的靶点,MSLNADC的研发也是在挑战和机遇中前行,各大MNC在其临床开发过程中同样也经历着波折。然而在这样一个在研管线并不算多的领域,荣昌生物和诺纳生物两家本土企业却迈出了积极的步伐。
表1:MSLNADCⅡ期在研管线

数据来源:药智数据
Anetumabravtansine(Bay94-9343)是拜耳旗下的一款MSLNADC药物,由全人源抗MSLN抗体通过氨基偶联与微管抑制剂美登素DM4组成,Anetumabravtansine的DAR为3.2,具有旁杀伤效果(BystanderEffect)。
Anetumabravtansine的开发并非一帆风顺。2022年,Anetumabravtansine二线治疗间皮素阳性的恶性胸膜间皮瘤,与长春瑞滨相比,并未改善无进展生存期。研究纳入248例经一线铂类/培美曲塞联合或不联合贝伐珠单抗治疗失败的患者,按2:1的比例分予Anetumabravtansine6.5mg/kgd1q21(166例)或长春瑞滨30mg/m2q7(82例),中位无进展生存期分别为4.3个月和4.5个月(HR=1.22,P=0.86),中位总生存期分别为9.5个月和11.6个月(HR=1.07,p=0.66)。
除了单药外,拜耳正探索Anetumabravtansine联合K药二线治疗间皮瘤,在2023WCLC上,拜耳披露了这项Ⅱ期研究的结果,18例患者接受anetumabravtansine和帕博利珠单抗联合治疗,17例患者接受帕博利珠单抗单独治疗,联合用药组和单药组的ORR分别为11%(2/18)和6%(1/17),中位无进展生存期分别为12.2m和3.9m。
就二线胰腺癌的治疗,Anetumabravtansine联合O药并未实现缓解,联合O药和吉西他滨同样未实现缓解,SD达100%,拜耳仍将探索Anetumabravtansine联合O药及吉西他滨治疗胰腺癌的潜力。
RC88是荣昌生物自主研发的靶向MSLN的ADC药物,2018年11月获批在中国开展I期临床试验,目前正处于II期临床试验阶段。2023年12月,RC88用于妇瘤的一项Ⅱ期临床试验申请获得美国FDA许可,即将在美国、中国、欧盟等多个国家和地区开展国际多中心临床研究。
除了单药使用,荣昌生物还为RC88积极拓展PD-1药物联用策略。2023年3月16日,RC88联合特瑞普利单抗在晚期恶性实体瘤患者安全性、耐受性、药代动力学特征及疗效的开放、多中心I/IIa期临床研究在我国获批。2023年6月26日,荣昌生物与信达生物达成合作,将合作探索PD-1抑制剂信迪利单抗与包括RC88在内的两款ADC联用的临床研究。
(2)CAR-T药物
目前,近十家企业布局MSLNCAR-T的研发,不难看出,MSLNCAR-T国内企业布局居多,反映了中国创新药企业对CAR-T疗法的高度关注。
表2:MSLNCAR-T在研管线
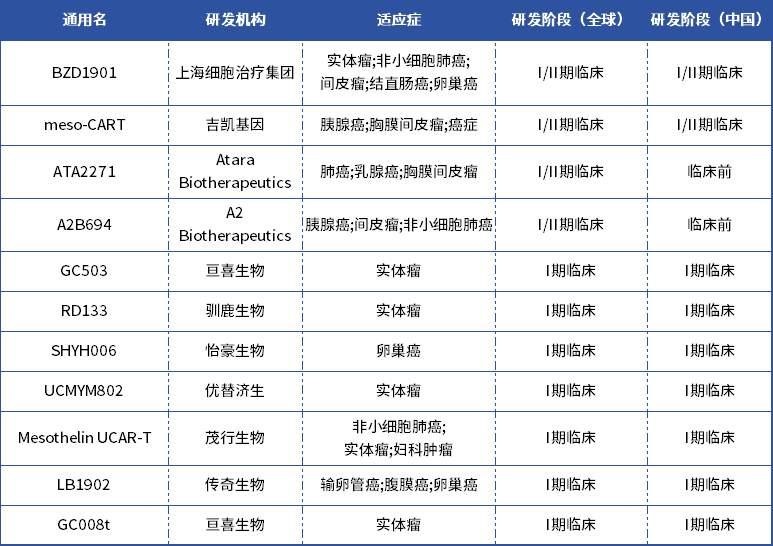
数据来源:药智数据
BZD1901是上海细胞治疗集团自主研发的自分泌纳米抗体CAR-T细胞药物。在2022ASCO上,上海细胞治疗集团披露了BZD1901的Ⅰ期结果,研究纳入9名受试者,在6名可评估的患者中,ORR达33.3%;在PD-L1阳性的患者中,ORR达66.7%。2023年5月,BZD1901项目成功获得FDA孤儿药资格认定(ODD),用于治疗间皮瘤。
ATA2271是AtaraBiotherapeutics旗下一款MSLNCAR-T,2020年底,拜耳曾就Atara的两个间皮素CAR-T项目(ATA2271在内)达成了6.7亿美元的合作协议。但由于ATA2271在一期出现致人死亡的严重不良事件,2022年5月,拜耳结束与AtaraBiotherapeutics的合作伙伴关系。
PM3006为普米斯生物旗下靶向间皮素(MSLN)的CAB-T细胞疗法,目前处于临床Ⅰ期,主要研究目的是探索靶向MSLNCAB-T细胞疗法的临床应用初步安全性和有效性。初步研究结果显示,患者对MLSNCAB-T具有良好的耐受性,爬坡剂量已到达1×107cells/kg,尚未发现剂量限制性毒性;在3×106cells/kg剂量下,3例患者中有2例患者出现了靶病灶的缩小,其中一例患者靶病灶缩小达到26.89%。
(3)抗体类药物
近年来随着抗体工程和抗体生物学领域的研究进展,国内外很多药企以及实验室将目光转向双抗以及多抗,双抗和多抗具有很大的研发和治疗潜力。
Harpoon的HPN536是一种三特异性T细胞激活结构,被用于治疗表达间皮素的实体瘤。除了与CD3和间皮素结合外,HPN536还与血清白蛋白结合,以增加该分子的血浆半衰期。
AMG305是安进基于其专有双特异性T细胞衔接器分子技术平台开发的一种靶向钙粘蛋白-3(cadherin-3,CDH3)和MSLN的双特异性抗体,是全球首款进入临床阶段的CDH3/MSLN双抗药物。安进于2023年在clinicaltrials.gov网站上登记了AMG305一项开放标签、非随机临床试验,拟纳入260例受试者,预计将于2023年6月15日开始,并于2026年10月11日完成。
表3:部分靶向MSLN的双抗/多抗药物
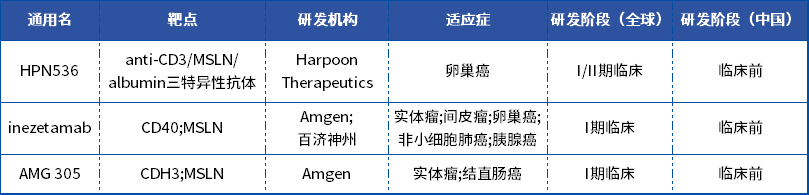
数据来源:药智数据
小结
鉴于MSLN在恶性间皮瘤、胰腺癌、卵巢癌等恶性肿瘤中呈现高表达,在健康组织和细胞中呈现低表达,有望成为肿瘤治疗的下一个明星靶点。
目前,针对MSLN靶点的研发,细胞疗法的研发最为火热,多家国内企业相继开展了MSLNCAR-T药物的研发,BZD1901在PD-L1阳性的间皮瘤患者中,ORR达66.7%,疗效十分显著。
拜耳深耕于MSLNADC,但在胰腺癌和间皮瘤,目前疗效有效,荣昌生物的RC88用于妇瘤的Ⅱ期临床试验申请获得FDA许可,在ASCO上展现出优异的临床效果,期待后续数据。
转载来源:药智头条 作者:橙子

 京公网安备 11010802028547号
京公网安备 11010802028547号