
2024年第一季度已经结束,FDA交出了怎样的成绩单?据统计,FDA的CDER在第一季度一共批准了10款新分子实体(NME)和新生物实体(NBE),同比落后于2023年Q1的13个。
表1 CDER 2024年Q1批准的NME和NBE药物
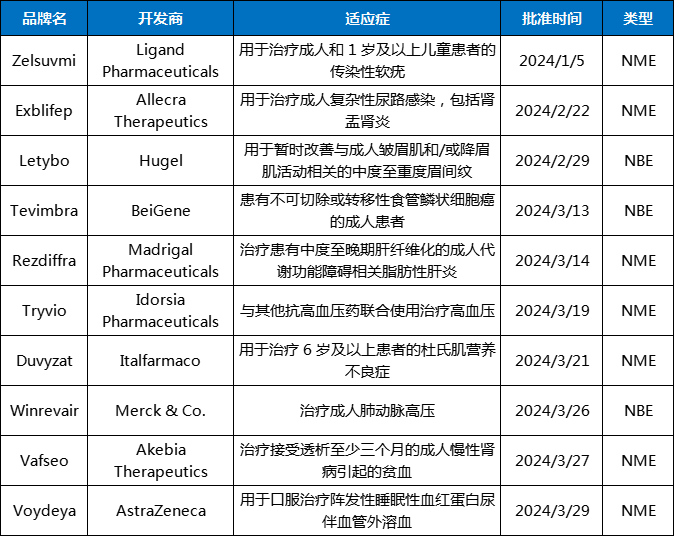
数据来源:FDA官网
往事不可追,来者犹可待。2024年第二季度,有哪些关键的审批即将到来?
01 FDA Q2重要审批
2024年第二季度,重要新药催化剂包括:用于治疗慢性阻塞性肺病的小分子药物ensifentrine(RPL554);用于治疗晚期小细胞肺癌的双特异性抗体tarlatamab。
首款慢性阻塞性肺病吸入剂Ensifentrine
Ensifentrine是Verona Pharma开发的first-in-class吸入式磷酸二酯酶3和4(PDE3/4)双重抑制剂,针对慢性阻塞性肺病(COPD)。
尽管PDE抑制剂在COPD治疗领域并不新鲜,但目前可用的都是口服制剂。Ensifentrine的雾化吸入制剂将有助于规避胃肠道副作用,而双重PDE3/4抑制则提供支气管扩张和抗炎作用。
Ensifentrine的NDA申请包括其III期ENHANCE试验提供的有效性和安全性数据,其中ensifentrine实现了严重的慢性阻塞性肺病患者的肺功能和症状终点的改善,大幅降低了COPD恶化的发生率和风险,在中重度COPD受试者人群中具有良好的耐受性。
Ensifentrine的PDUFA日期为2024年6月26日,FDA目前不打算召开咨询委员会会议来讨论其监管审批。
这款十多年来第一个对抗慢性阻塞性肺病的新疗法令业界感到兴奋,尤其是它有可能治疗遭受耐药性影响的重症患者。
Verona Pharma还在探索不同剂型(干粉吸入器和加压计量吸入器)、组合疗法(与glycopyrrolate)和在其他呼吸系统适应症中使用Ensifentrine的可行性。
双特异性T细胞接合剂药物Tarlatamab
Tarlatamab是安进针对SCLC(晚期小细胞肺癌)的研究性靶向疗法,凭借BiTE®技术平台,通过结合T细胞上的CD3和SCLC细胞上的DLL3(δ样配体3),令患者自身的T细胞接近SCLC肿瘤细胞。这个过程会导致免疫突触的形成和癌细胞的裂解。
DLL3是SCLC提供的有前景的治疗靶点,大约85%至94%的患者在SCLC细胞的细胞表面表达DLL3,但在正常细胞中表达很少。
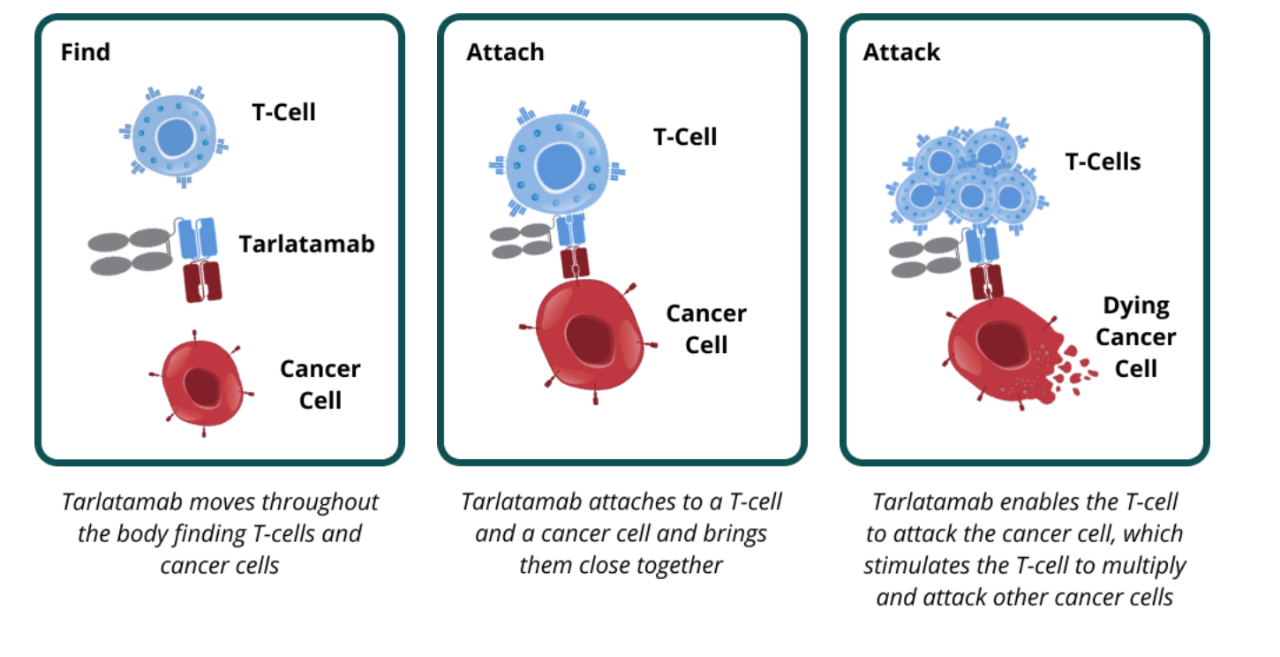
图1 双特异性T细胞接合剂Tarlatamb作用机制示意图
图片来源:Amgen
Tarlatamab背后的BiTE®(双特异性T细胞接合剂)技术是一种靶向免疫肿瘤学平台。它有两个关键部分:附着在T细胞(一种免疫细胞)上的部分和附着在癌细胞上的部分。Tarlatamab将患者自身的T细胞与肿瘤特异性抗原接合,激活T细胞的细胞毒性潜力,消除肿瘤细胞(图1)。BiTE具有通过肿瘤特异性抗原治疗不同肿瘤类型的潜力。
FDA于2023年12月授予tarlatamab BLA优先审评资格,用于治疗铂类化疗期间或之后疾病进展的晚期SCLC成人患者的三线或以上治疗,并将PDUFA日期定为2024年6月12日。
02 FDA Q2待审批的NME/NBE
CDER在2024年第二季度即将审批的NME/NBE新药数量环比第一季度显著增加,达到了15种,具体内容见表2。
表2 CDER 2024年第二季度审批的NME/NBE
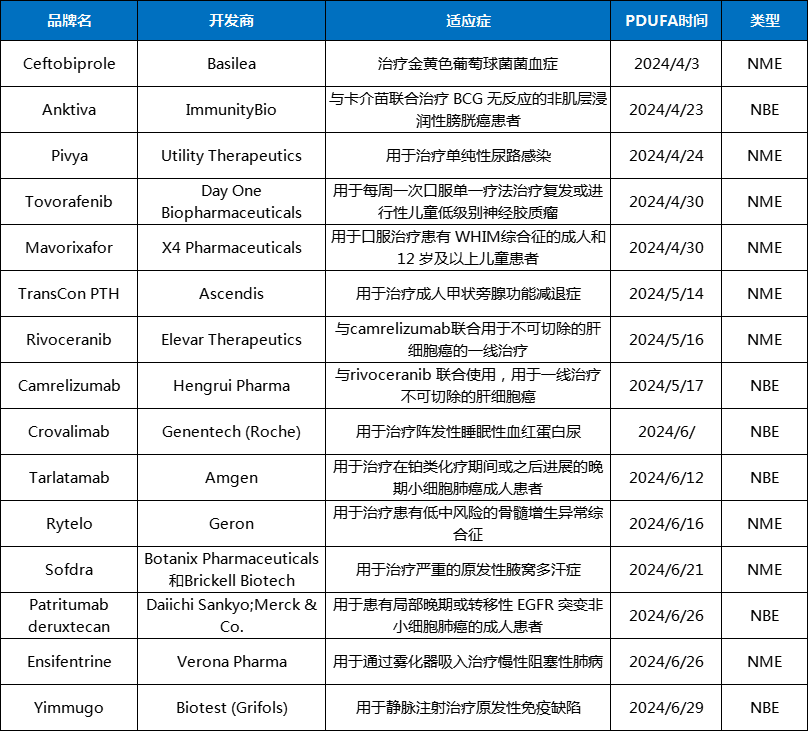
数据来源:FDA官网
Ref.
1.FDA Performance Tracker:User Fee Goal Dates.Pink Sheet.Retrieved on 20.03.2024.
2.FDA Performance Tracker:Novel CDER Approvals.Pink Sheet.Retrieved on 20.03.2024.
3.Shui-Jezierski,A.Upcoming market catalysts in Q2 2024.Nature Reviews Drug Discovery.13.03.2024.
转载来源:药智新闻 作者:骥丹翼

 京公网安备 11010802028547号
京公网安备 11010802028547号