
2023年,美国FDA生物制品评价和研究中心(CBER)批准了5款基因疗法(不含细胞疗法、小核酸药物),数量为历史新高。
2017年美国FDA批准了Spark Therapeutics治疗遗传性眼疾的基因疗法Luxturna,成为FDA批准的第一款用于遗传疾病的基因疗法。不过此后几年批准的基因疗法数量寥寥,直到2022年、2023年各批准了4个和5个基因疗法,揭示了该类型新药终于迎来爆发期。
表1. 美国FDA批准的基因疗法
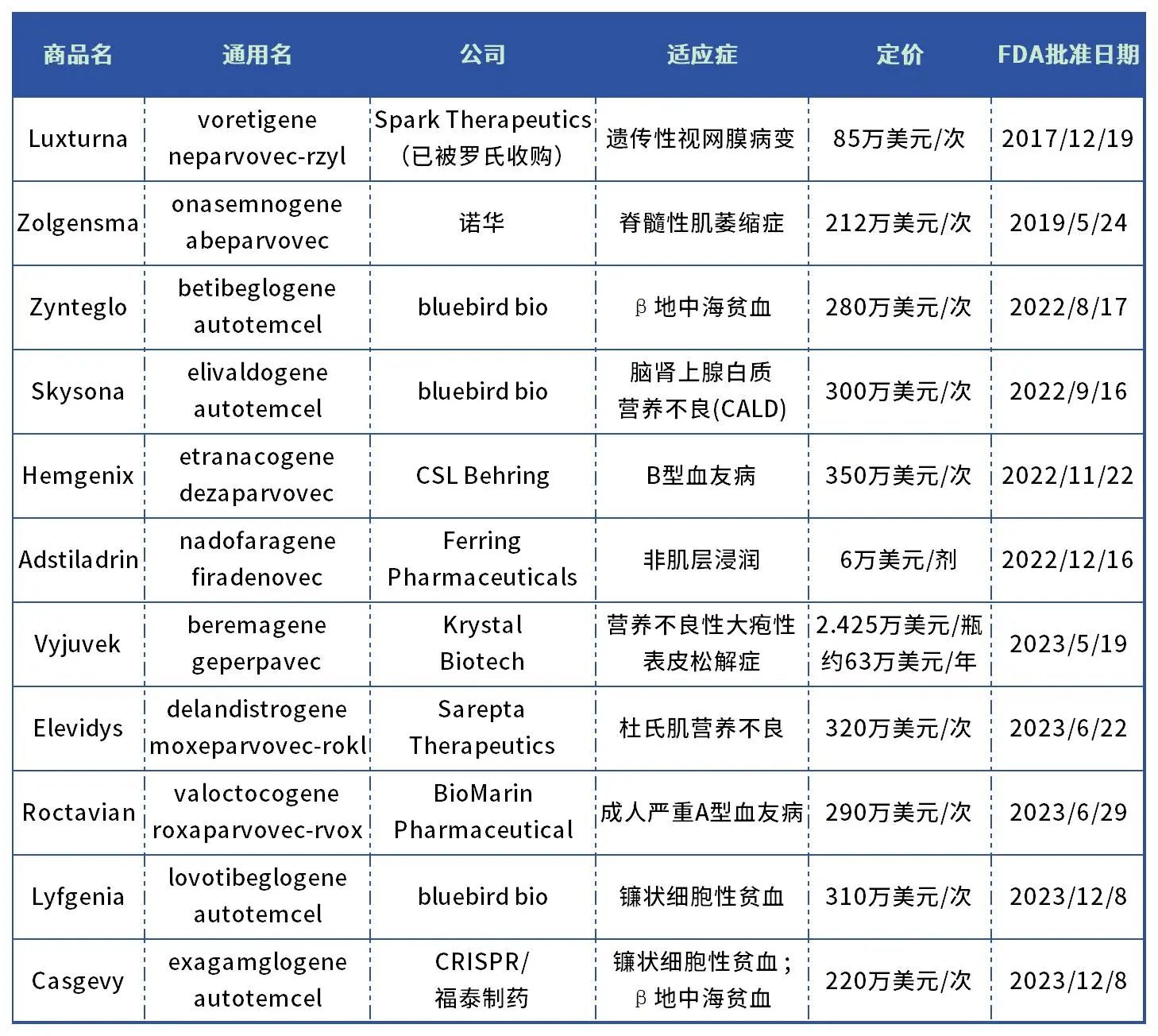
(不含细胞疗法、小核酸药物)
数据来源:药智数据、药智头条整理
这些基因疗法瞄准遗传性疾病,多数药物曾获得过“孤儿药”和“重大突破药”认定,获批上市对患者意义重大。
另一方面,基因疗法高昂的定价争议颇多。不过基因疗法属于个性化治疗、精准医疗,不仅成本高,而且患者数量少,药企想要收回研发成本定价必然高,短期内还看不到下降的可能。据笔者统计,FDA批准的首个基因疗法Luxturna定价85万美元一次,此后批准的基因疗法中,8款超过200万美元/次,最高达350万美元/次(约2500万人民币/次)。
基因疗法定价虽高,但美国医药市场强大的支付能力支持下,不少贵价药依然取得了不错的销售成绩。例如,诺华的Zolgensma2022年实现销售额13.7亿美元,Sarepta的Elevidys在2023年6月才获FDA批准,2023年8月进行销售交付,小半年就实现销售额2.004亿美元(约14.37亿元)。
01 Luxturna
2017年12月,FDA批准了Spark Therapeutics(已被罗氏收购)公司研发用于治疗特定遗传性眼疾的基因疗法Luxturna(voretigene neparvovec-rzyl),这是美国首款上市的针对遗传性罕见病的基因疗法,同时也是首款在美国获批、靶向特定基因突变的“直接给药型”的基因疗法。
RPE65基因突变引起的RPE65酶水平下降或缺失会让患者的视力受损,最终导致失明。Luxturna直接在眼内注射带有RPE65基因的腺相关病毒(AVV),使正常功能的RPE65基因在视网膜色素上皮细胞中表达,从而恢复视力。
该药物单价为42.5万美元,双眼治疗费用达85万美元,但如果该药物不起作用,不会收取全部费用。根据Spark财报显示,截至2019年9月Luxturna共取得5500万美元净销售额。2019年10月罗氏宣布收购Spark,此后罗氏未再披露Luxturna的销售情况。
02 Zolgensma
Zolgensma是由诺华开发的一款AAV基因疗法,于2018年斥资87亿美元收购AveXis所得。该疗法于2019年5月获FDA批准上市,用于治疗脊髓性肌萎缩症(SMA)。
SMA是一种罕见的遗传性神经肌肉疾病,是导致儿童死亡的最常见的遗传病,由编码运动神经元存活蛋白的SMN1基因突变引起。Zolgensma 通过单次静脉注射即可实现持续的 SMN 蛋白表达,从而阻止疾病进展。
Zolgensma定价 212.5 万美元,上市首年Zolgensma就实现销售额3.61亿美元;2020年达9.2亿美元;2021年达13.51亿美元;2022年达13.7亿美元。
03 Zynteglo
Zynteglo由Bluebird bio(蓝鸟生物)开发,是首款治疗β-地中海贫血症的基因药物,于2022年8月获得FDA批准上市,用于治疗需要接受常规血红细胞输注的β地中海贫血患者。
Zynteglo通过慢病毒载体将表达正常血红蛋白β亚基的基因(βA-T87Q-珠蛋白基因)在体外植入到从患者体内取出的造血干细胞中,再将这些细胞回输入患者体内,这些造血干细胞在输注回患者体内后,会源源不断地生成具有正常功能的血红细胞,极大减少患者对输血的需求。
该药物定价280万美元,不过Zynteglo承诺,如果没有达到治疗效果,将退还80%的治疗费用。2023年前三季度Zynteglo销售额867.8万美元,约3~4名患者接受了治疗。
04 Skysona
Skysona是Bluebird bio(蓝鸟生物)开发的一种一次性基因疗法,于2022年9月获FDA批准用于减缓4-17岁患有早期活动性脑肾上腺脑发育不良(CALD)的男性患者的疾病进展。
CALD是一种X连锁的隐性遗传神经退行性疾病,是肾上腺脑白质营养不良症的一种较为严重的表型,由致病基因ABCD1的突变引起。Skysona利用Lenti-D慢病毒载体(LVV)进行体外转导,将ABCD1基因的功能拷贝添加到患者自身的造血干细胞(HSC)中,功能性ABCD1基因的加入能使患者体内产生ALD蛋白。SKYSONA治疗的目的是稳定CALD的进展,从而尽可能地保留神经功能,包括保留运动功能和沟通能力。
该疗法定价为300万美元,2023年前三季度销售额1086万美元,约有3~4名患者接受治疗。
05 Hemgenix
目前CSL Behring和uniQure的血友病药物Hemgenix以350万美元的价格位列全球最贵药物榜首,2023年6月,CSL Behring和uniQure宣布首名患者接受了B型血友病基因疗法Hemgenix治疗,完成商业化首单,尚未实现大范围推广。
Hemgeni是CSL Behring开发的一款基于AAV5载体的基因疗法,该药物搭载有凝血因子IX(FIX)基因变体(FIX-Padua),通过静脉给药,给药后该基因可在肝脏中表达FIX 凝血因子,分泌后进入血液发挥凝血功能,从而达到治疗目的,理论上一次给药长期有效。该疗法于2022年11月获FDA批准上市,用于治疗处于凝血IX因子预防性输血治疗阶段,以及曾经出现过危及生命的出血事件,或出现反复严重的自发性出血事件的成年B型血友病患者。这是全球首款治疗血友病B成人患者的基因疗法。
该产品定价350万美元一剂,是目前全球最贵药物。尽管价格高昂,但CSL Behring认为该药物将“为整个医疗保健系统节省大量成本”,并“通过降低年出血率、减少或消除预防性治疗和保持多年的高IX因子水平,显著降低B型血友病患者的经济负担”。
06 Adstiladrin
Adstiladrin(nadofaragene firadenovec)由Ferring Pharmaceuticals开发,于2022年12月获美国FDA批准,用于治疗卡介苗(BCG)无效的高危非肌肉浸润性膀胱癌(NMIBC)的原位癌(CIS)与或非乳头状肿瘤的成年患者。这是首个被批准用于膀胱癌的基因疗法。
NMIBC是膀胱癌的一种亚型,它也被称为“浅表”膀胱癌,在新诊断出患有膀胱癌的人中,大约75%患有NMIBC。BCG(卡介苗)仍然是高级别NMIBC患者的一线治疗标准。然而,超过 50% 接受BCG初始治疗的患者将在一年内出现疾病复发和进展,其中许多发展为对BCG无反应的疾病。Adstiladrin是一种基于非复制型腺病毒载体的基因疗法,含有干扰素alfa-2b基因,这种新颖的基因治疗方法可将患者自身的膀胱壁细胞转变为干扰素微工厂,从而增强人体对癌症的天然防御能力。
Adstiladrin每3个月通过膀胱内灌注进行一次,定价为每单位剂量6万美元。
07 Vyjuvek
Vyjuvek是Krystal Biotech公司开发的一种外用基因疗法,于2023年5月获FDA已批准,用于治疗6个月大及以上年龄的营养不良性大疱性表皮松解症(DEB)。这是FDA批准的首个可重复给药的外用基因疗法,同时也为DEB患者带来了首款获批基因疗法。
DEB患者也被称为“蝴蝶宝宝”,是由COL7A1基因中的一个或多个突变引起的一种罕见的遗传性皮肤病。由于患者缺乏功能性锚定纤维,导致皮肤或黏膜受到轻微外伤或摩擦后会出现破损、水疱或撕裂。
Vyjuvek使用单纯疱疹病毒1型(HSV-1)作为基因递送载体,大概每周使用一次,可以直接涂抹在患者皮肤伤口处,通过恢复患者角质形成细胞和成纤维细胞中COL7的表达来实现治疗作用。Vyjuvek临床试验数据显示,局部给药B-VEC疗法能够显著促进DEB患者在3个月和6个月时的伤口完全愈合。
该疗法用药每瓶售价为24250美元,患者平均每年使用26瓶,每年治疗费用约63万美元,经过政府强制折扣后为48.5万美元。
08 Elevidys
Elevidys是Sarepta Therapeutics公司和罗氏(Roche)联合开发的一种基因替代疗法,于2023年6月获FDA批准,用于治疗4至5岁杜氏肌营养不良患者。这是全球首个治疗杜氏肌营养不良症(DMD)的一次性基因疗法。
DMD是一种致命的、多发于男性的罕见X连锁退行性神经肌肉疾病,由于患者体内抗肌萎缩蛋白(dystrophin)基因的突变或缺失,无法产生相应蛋白维持骨骼肌及其他组织细胞膜的稳定性,导致肌肉组织萎缩或变性,最终由于呼吸或心脏衰竭死亡。Elevidy通过将正常的基因输注到患者体内,该疗法帮助患儿持续产生具有抗肌萎缩蛋白功能的重组蛋白。
在Elevidys获批前,全球有4款治疗DMD的“外显子跳跃”疗法,其中3款都来自Sarepta这家公司。但这些疗法需定期注射给药,且临床疗效都并不理想。Elevidys作为一种基因替代疗法,目标是实现一次性给药,无论患者的基因突变出现在抗肌萎缩蛋白基因的何处,都能从根本上替代有缺陷的基因。该疗法定价为320万美元一针。2023年8月,Elevidys进行销售交付,2023年Elevidys销售额约2亿美元(约14亿人民币)。
09 Roctavian
Roctavian(valoctocogene roxaparvovec)是BioMarin开发的一种基因疗法,于2023年6月获FDA批准,一次性单剂量输注用于治疗严重 A 型血友病。这是首个获FDA批准治疗严重血友病A患者的基因疗法。
血友病A(HemophiliaA,HA)是一种罕见遗传性出血性疾病,患有严重A型血友病的成年人面临终生负担,需要频繁输液,并且出现健康并发症的风险很高。Roctavian是一款通过使用AAV5病毒载体递送表达凝血因子Ⅷ的转基因的基因疗法,旨在取代突变基因的功能,使患有严重 A 型血友病的患者能够产生自己的 FVIII,从而限制出血事件。Roctavian定价为290万美元,虽然价格高昂,但如果可以让患者凝血因子恢复一定的水平,不需要反复输注,患者获益依然可观。
10 Lyfgenia
Lyfgenia(Lovo-cel;lovotibeglogene autotemcel)是Bluebird bio(蓝鸟生物)开发的一种一次性基因疗法,2023年12月获FDA批准用于治疗12 岁及以上患有复发性血管闭塞危象 (VOC) 的镰状细胞病 (SCD) 患者。
Lyfgenia是一款基于慢病毒载体的细胞基因疗法,通过慢病毒载体将功能性β珠蛋白基因永久添加到患者自身的造血干细胞(HSC)中,可持久产生具有抗镰状细胞特性的血红蛋白(HbAT87Q型),HbAT87Q型与野生型 HbA 具有相似的氧结合能力,限制红细胞镰状化,并有可能减少血管闭塞事件 (VOE)法。该疗法售价为310万美元,是市场上第三昂贵的疗法。
11 Casgevy
2023年11月,全球首款CRISPR/Cas9基因编辑药物Casgevy(Exa-cel; exagamglogene autotemcel )在英国批准上市,用于治疗12岁及以上输血依赖性β地中海贫血(TDT)或伴有复发性血管闭塞危象(VOC)的镰状细胞病(SCD)患者。12月8日,Casgevy获美国FDA批准用于SCD,2024年1月,FDA又批准了TDT。
Casgevy是由CRISPR Therapeutics和Vertex共同推出的一款自体、ex vivo CRISPR/Cas9基因编辑药物,该疗法需要先提取患者自身的造血干细胞,再通过电转的方式将CRISPR/Cas9系统递送到造血干细胞,靶向BCL11A红细胞系特异性增强子并且特异性沉默BCL11A基因,重新激活胎儿血红蛋白(HbF)的生成并表达高水平的HbF,从而缓解TDT患者的输血需求,减少SCD患者的疼痛和血管闭塞性危象。
CRISPR/Cas9是目前主流的基因编辑技术,Casgevy的获批标志基因治疗领域的又一大里程碑。
Casgevy一次性治疗定价为220万美元,低于蓝鸟生物SCD基因疗法Lyfgenia的310万美元和TDT基因疗法Zynteglo的280万美元。
来源:药智头条 作者:游游

 京公网安备 11010802028547号
京公网安备 11010802028547号