
2023年,基因疗法在多个领域取得突破性进展,如杜氏肌萎缩症、血友病等治疗领域。
不仅如此,2023年全球在研基因疗法药物新增数量首次破百,为118个,成为历年之最。
针对传统药物无法治疗的疾病,基因疗法似乎让广大患者看到了治愈的希望,穿越黑暗,基因疗法药物迎来发展曙光。
01
在研新增破百,
创下历年之最
据药智数据显示,当前全球共有上千款基因疗法药物处于不同研发阶段,并且每年新增数量呈现出加速增长的趋势。下表1为笔者通过药智数据所整理出近十年来每年新增的在研基因疗法药物数量。
表1基因疗法药物每年新增数量(不完全统计)
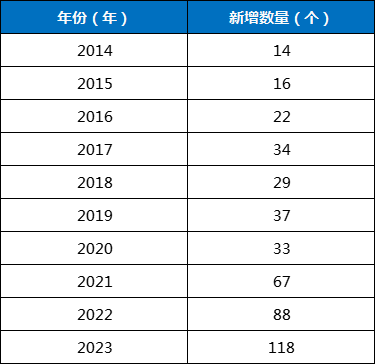
数据来源:药智数据
可以看到,自2014年以来,在研基因疗法药物数量不断增长,于2023年破百,为118个,创下历年之最。
随着越来越多的基因疗法产品获批上市,以及相关技术的快速发展,基因疗法或将迎来发展的时代浪潮。FDA曾表示,预计到2025年,每年将批准10至20种基因疗法药物。
02
2023年获批盘点:
5大基因疗法药物
1.Vyjuvek:首款可重复给药的外用基因疗法药物
Vyjuvek于2023年05月获FDA批准上市,该药物由KrystalBiotech开发,用于治疗营养不良性大疱性表皮松解症(简称“DEB”),DEB是一种罕见且严重的单基因遗传性皮肤病,主要影响患者的皮肤以及粘膜组织。
Vyjuvek是一款使用单纯疱疹病毒为载体的基因疗法药物。该药物一经问世就囊括多项第一,首先该药物是全球首款可重复给药的基因疗法药物,其次该药物是FDA首款治疗DEB的药,同时该药物也是首个外用给药的基因疗法药物。当前基因疗法药物多数是基于腺病毒相关载体,而Vyjuvek则是使用的单纯疱疹病毒为载体,这意味着基因疗法又向前迈出了关键的一步。
临床数据显示,患者经过24周的治疗后,Vyjuvek组治疗的伤口中65%完全愈合,安慰剂组为26%。
市场方面,据KrystalBiotech2023年三季度报显示,截至2023年9月30日,公司已经收到284份患者的用药申请,公司计划从2024年第一季度开始报告接受治疗的患者人数,进而更好的预测Vyjuvek的销售额。
2.Elevidys:全球首款杜氏肌萎缩症基因疗法药物
Elevidys由Sarepta研发,于2023年获FDA批准上市,是全球首款治疗杜氏肌萎缩症的基因疗法药物,适应人群为4-5岁儿童
临床1/2期数据显示,患者使用该药52周后,NSAA评分可改善3.8分。使用四年后,患者NSAA评分的平均差异可达7.0分。
价格方面,Elevidys定价320万美元/剂,尽管价格如此高昂,2023年度Elevidys市场销售额依旧表现不俗。Elevidys2023全年总销售额约为2亿美元,约合人民币14亿元。
3.Roctavian:全球首款A型血友病基因疗法药物
由BioMarin研发,于2023年6月29日获批上市,是全球首款用于治疗A型血友病的基因疗法药物。
临床数据显示,接受Roctavian治疗后,患者的年化出血率可减少52%。并且相比于传统的FVIII预防性治疗,使用Roctavian治疗的患者出血次数更少,传统的FVIII预防性治疗自发性出血与关节出血次数为2.3次/年与3.1次/年,Roctavian治疗为2.3次/年与3.1次/年。此外根据临床3期GENEr8-1结果,患者出血量减少82.9%。
价格方面,该药物在美国定价290万美元。市场方面,根据BioMarin2023年三季度财报显示,Roctavian销售额为82.2万美元,相比于Elevidys的销售额目前具有一定差距,但由于该药物上市时间较短,未来表现如何犹未可知。据预测,该药物巅峰销售额可达22亿美元。
4.Casgevy:首款基于CRISPR/Cas9基因编辑技术的基因疗法药物
Casgevy为Vertex/CRISPR共同研发的CRISPR/Cas9基因编辑疗法药物,该药物于2023年11月份在英国获批上市,12月份在美国获批上市,是全球首款基于CRISPR/Cas9基因编辑技术的基因疗法药物,用于治疗12岁及以上患有复发性血管闭塞现象的镰状细胞病。
临床数据显示,使用Casgevy治疗的患者中,31名中有29名患者在至少连续12个月的时间里未出现严重血管阻塞事件,有效性达93.5%。
5.Lyfgenia:FDA审批的双子星
两款同适应症的基因疗法同日获FDA批准,一款即前文提到的Casgevy,另一款则是Lyfgenia。该药物由蓝鸟生物研发,适应症同为12岁及以上患有复发性血管闭塞现象的镰状细胞病。
临床数据显示,94%的患者使用Lyfgenia后未发生严重血管闭塞,88.2%的患者使用Lyfgenia后未出现血管闭塞事件,效果方面表现的也是可圈可点。然而不良反应方面,使用Lyfgenia或许会导致患者患血液恶性肿瘤,因此Lyfgenia被FDA黑框警告。
Lyfgenia定价高于Casgevy,为310万美元。由于两款药物适应症相同,且同日获批,FDA此举亦是博得了大家的目光,未来谁又能脱颖而出,值得期待。
03
前途光明
仍需解决两大“拦路虎”
1.高昂价格
众所周知,基因疗法药物往往伴随着天价,高昂的价格不光患者难以接受,国家医保亦是无力承担。但基因疗法药物定价如此之高,其实也并非企业的本意,实在是基因疗法药物的研发成本过于高昂。
基因疗法药物的核心为病毒载体,其高昂的生产成本也是基因疗法药物定价较高的主要原因之一,同时也是未来制约行业发展的重要因素。
2.安全性存疑
虽然基因疗法在治疗遗传性疾病方面展现出强大的潜力,但安全性问题也是大家很关注的问题。由于基因疗法药物往往涉及的技术比较新颖,相比于传统药物,并没有成熟的非临床研究评价体系,因此存在较大的不确定性。未来发展的方向之一,需建立成熟的药物研发体系,更大程度确保药物的安全性。
相比于传统药物,基因疗法药物具有其独特的“魅力”,但价格及安全性又是阻碍患者用药的“拦路虎”,相信这两大问题解决后,基因疗法药物市场将迎来大爆发。
参考文献
[1]BioMarin等公司2023年三季度报.
[2]https://www.fda.gov/news-events/press-announcements/fda-approves-first-topical-gene-therapy-treatment-wounds-patients-dystrophic-epidermolysis-bullosa
[3]药智数据
[4]https://www.fda.gov/news-events/press-announcements/statement-fda-commissioner-scott-gottlieb-md-and-peter-marks-md-phd-director-center-biologics
[5]https://ir.krystalbio.com/news-releases/news-release-details/krystal-biotech-receives-fda-approval-first-ever-redosable-gene
来源:药智网 作者:四月的雨

 京公网安备 11010802028547号
京公网安备 11010802028547号