
全球核药版图,正在悄悄发生改变。近日,诺华公布2023年业绩,全年净销售额454.4亿美元,同比增长10%,核心营业收入增长18%,净收入为86亿美元。值得注意的是,诺华旗下2款核药Lutathera和Pluvicto在2023年总销售额突破15亿美元(折合人民币114亿元),诺华成为第一批“吃螃蟹”的企业之一。
百亿「核药捕手」一鸣惊人,诺华如何拿下硬骨头?
01
拿下114亿,
诺华引领核药狂潮
核药主要分为诊断用放射性药物和治疗用放射性药物两大类,治疗类放射性药物可以通过核素对病变组织进行选择性和靶向性治疗。
在早期的的发展中,放射性药物一直主要作为重要的癌症诊断药物被开发使用,诊断性核药占据80%以上市场,治疗性核药受限于上游核素产能,以及较为严格的审批流程和使用条件,仅占比16.6%。
目前,核药细分赛道中的放射性核素偶联药物(RadionuclideDrugConjugates,RDC)成为研发热点。
诺华是RDC领域的王者,2016年后全球已有11款RDC药物获批上市,其中5款药物为诺华公司产品,且诺华的Lutathera和Pluvicto是唯一2款用于治疗的RDC药物[1]。
Lutathera于2018年1月26日被FDA批准上市,用于治疗生长抑素受体(SSTR)阳性的胃肠胰神经内分泌肿瘤患者。
Lutathera在上市首年销售额达到了1.67亿美元,2019年增长到4.41亿美元,2022年营收为4.71亿美元,2023年销售额增长至6.05亿美元[2]。
Pluvicto显示出比Lutathera更强的销售爆发力,在产能受限的情况下,Pluvicto上市首年即实现2.7亿美元销售额,2023年销售总额达9.8亿美元,同比增长261%(图1)[2]。

图1Pluvicto销售额
图片来源:诺华2023年财报
Pluvicto于2022年3月23日被FDA批准上市,用于治疗PSMA阳性mCRPC(转移性去势抵抗性前列腺癌)患者,成为了全球首款靶向PSMA的放射性配体疗法。
Pluvicto药物是采用了的放射性粒子核素Lu-177,与传统的癌症治疗方法相比,Lu-177治疗方法具有许多优势:它可以最大限度地减少住院时间;选择性好,仅影响病理灶,而不影响健康组织;杀伤能力强,该药物的活性成分会影响不同位置的癌细胞,不仅可以对抗原发性肿瘤,还可以对抗转移癌细胞。
这也使得Pluvicto在临床试验中也取得优异的效果。在Ⅲ期VISION临床试验中,针对mCRPC患者,使用Pluvicto+标准疗法的中位总生存期为15.3个月,而对照组为11.3个月,中位总生存期延长4个月[3]。
2023年10月份,诺华公布了Pluvicto的III期PSMAfore试验积极数据:PSMAfore达到了无影像学进展生存期(rPFS)主要终点,HR为0.411,与对照组相比,Pluvicto组的中位rPFS增加了一倍以上,达到12个月[4]。
除了已上市的Lutathera和Pluvicto,诺华还有两款处于临床1期的RDC药物177Lu-NeoB、225Ac-PSMA-R2和225Ac-PSMA-617(图2)[2]。
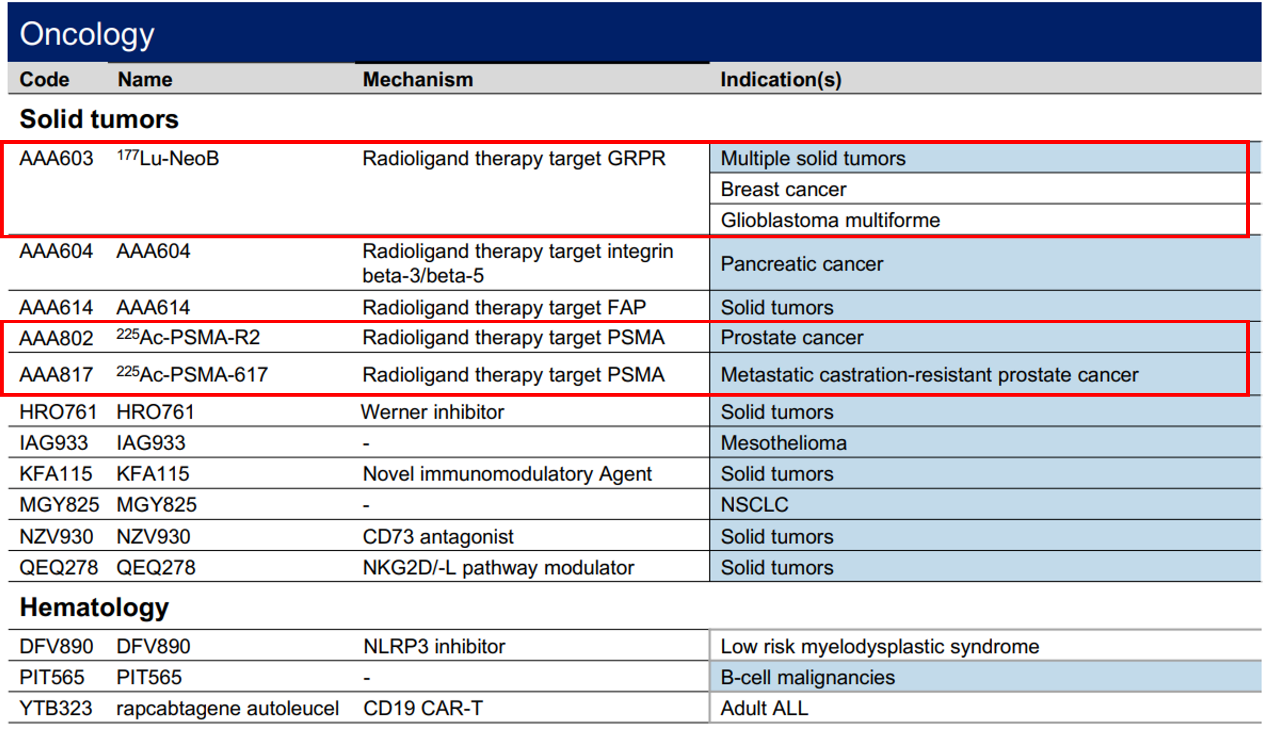
图2诺华肿瘤领域临床1期管线
图片来源:诺华2023年财报
Pluvicto亮眼的销售额,也促使全球药企纷纷加入布局RDC药物,抢夺这一块蛋糕,如罗氏、礼来和BMS于2023年先后收购或合作进军核药领域。
02
不止于核药,
全面围猎乳腺癌赛道
Kisqali是诺华肿瘤领域的重磅药物,相继于2017年3月和2023年1月在美国和中国获批上市,与芳香酶抑制剂联用一线用药治疗HR阳性以及HER2阴性的绝经后晚期转移性乳腺癌女性患者,Kisqali在获批之前已获得突破性疗法和优先审评认证。
作为目前国内唯一获批晚期一线绝经前适应症的CDK4/6抑制剂,Kisqali将为中国绝经前和围绝经期HR+/HER2-晚期乳腺癌患者提供一种新的治疗选择,并带来更长生存期和更优生活质量的希望[5]。
此前,Kisqali的MONALEESA-2试验结果显示:中位随访6.6年后,Kisqali组334例患者(54.2%)中有181例死亡,安慰剂组334例患者中有219例死亡(65.6%)。
与安慰剂加来曲唑相比,Kisqali联合来曲唑显示出显著的总生存获益。Kisqali联合来曲唑组的中位总生存期为63.9个月,安慰剂加来曲唑组为51.4个月,生存获益超过12个月[6]。
2023年12月份,诺华公布了Kisqali的III期NATALEE试验的最新侵袭性无病生存期(iDFS)分析结果:与单独使用标准内分泌治疗相比,Kisqali辅助联合非甾体芳香化酶抑制剂治疗可使II期和III期HR+/HER2-早期乳腺癌患者的疾病复发风险降低25.1%[7]。
Kisqali是除辉瑞的Ibrance之外第二款上市的CDK4/6抑制剂,凭借优秀的疗效和不断获批新的适应症,Kisqali销售额逐年上市,2023年销售额同比增长75%至20.8亿美元,而Ibrance占比受专利到期以及Kisqali等其它CDK4/6抑制剂等影响有所下滑(图3)。
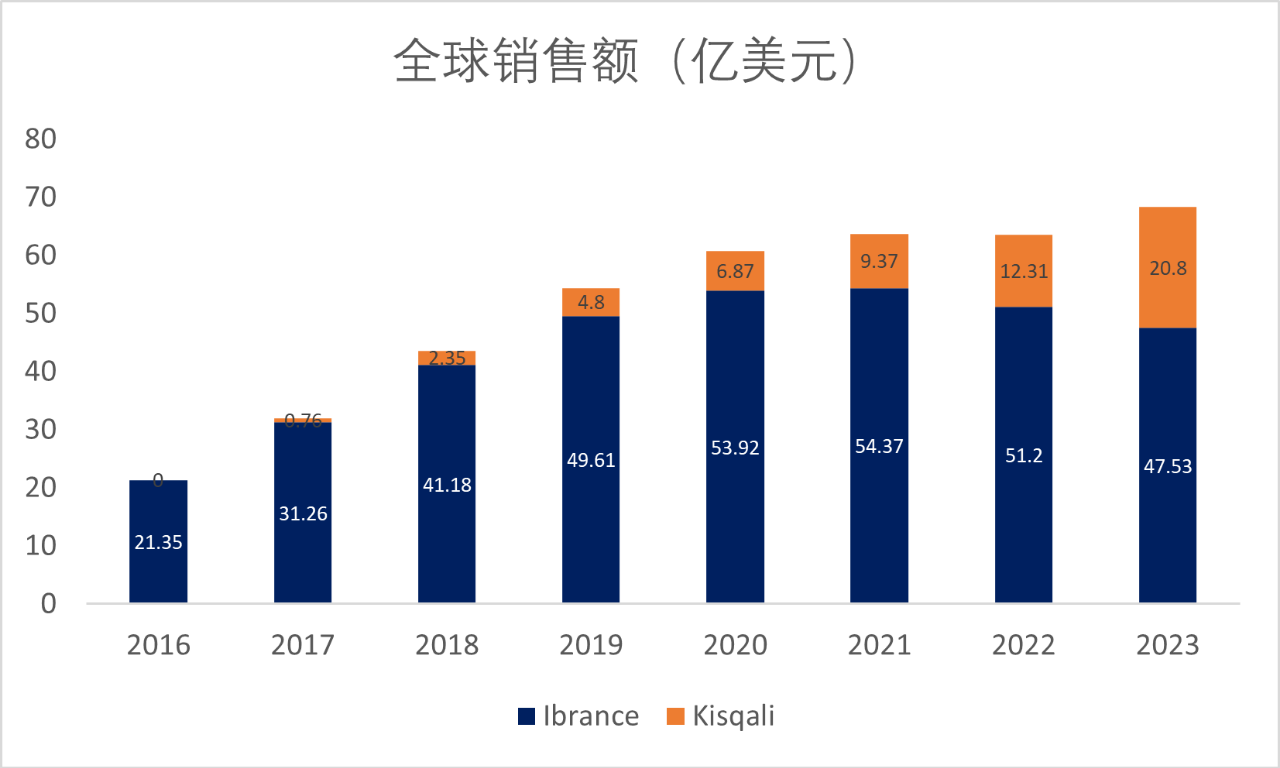
图3Ibrance和Kisqali销售额
图片来源:辉瑞、诺华财报
03
攻城自免领域,
BTK抑制剂“打头阵”
BTK抑制剂在血液瘤领域取得巨大成功,尤其是伊布替尼,曾在2021年达到97.8亿美元销售额峰值。
截至目前,全球已有6款用于治疗血液瘤的BTK抑制剂获批上市,老靶点新用途,很多药企在积极开发BTK抑制剂在自免领域的应用。
然而BTK抑制剂在自免领域的开发并不顺利,制药巨头们接连碰壁,好在诺华的Remibrutinib在治疗慢性自发性荨麻疹(CSU)的两项3期REMIX-1和REMIX-2均达到主要终点,给BTK抑制剂进军自免领域打了一针强心剂[8]。
CSU是持续6周或更长时间的慢性荨麻疹的医学术语,其根本原因是内部而不是外部暴露于任何过敏原。CSU影响全球4000万人,其特征是瘙痒的荨麻疹(风团)和/或深部组织肿胀(血管性水肿),可发生在面部、喉咙、手和脚。患者可能会在发生荨麻疹的皮肤上出现灼热、刺痛和酸痛,从而严重影响他们的生活质量。
H1-抗组胺药是CSU的一线治疗药物,然而大约60%的患者仅使用抗组胺药无法充分控制,并继续忍受CSU的痛苦症状。
BTK抑制剂作为对抗组胺药效果不好的患者的另一种选择,Remibrutinib如果获批有可能成为在十年内首个新的CSU疗法。
不止Remibrutinib勇闯自免领域,很多BTK抑制剂都在探索自免疾病,如赛诺菲的两款BTK抑制剂Rilzabrutinib和tolebrutinib都处于临床3期,分别用于治疗特发性血小板减少性紫癜、多发性硬化症等(表1)。
表1部分临床在研的用于治疗自免疾病的BTK抑制剂
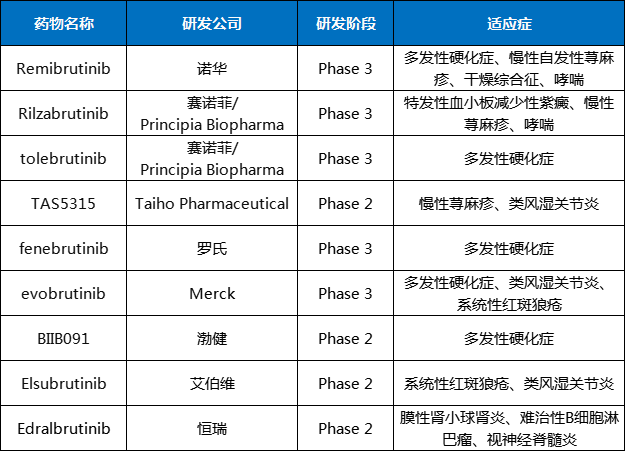
数据来源:药智数据、各大公司官网等公开资料
04
结语
2023年的诺华业务进行了大调整,剥离了仿制药业务,专注于创新药领域,临床管线遍布肿瘤、自免领域、心血管疾病等,抓住了核药的机遇,在RDC领域处于领先地位。
同时,诺华也公布了2024年指引,净销售额预计将实现中个位数增长,核心营业收入预计将实现高个位数增长,预计2023-2028年净销售额将以5%cc的复合年增长率增长,到2027年核心销售额将增长~40%。
参考文献
1.Big生物创新社:核药:前世今生、市场规模、准入壁垒、研发热点
2.Q42023resultsInvestorpresentationJanuary31,2024
3.FDAapprovesPluvictoformetastaticcastration-resistantprostatecancer
4.NovartisPluvicto™showsclinicallymeaningfulandhighlystatisticallysignificantrPFSbenefitinpatientswithPSMA-positivemetastaticcastration-resistantprostatecancerinthepre-taxanesetting
5.“丽”抗粉红杀手唱响生命“凯”歌——国内首个晚期一线绝经前乳腺癌CDK4/6抑制剂凯丽隆®在华获批
6.GabrielN.Hortobagyi,M.D.et.al,OverallSurvivalwithRibociclibplusLetrozoleinAdvancedBreastCancer,NEnglJMed2022;386:942-950
7.LatestNovartisKisqali®NATALEEanalysisreinforces25%reductioninriskofrecurrenceacrossbroadpopulationofpatientswithearlybreastcancer;supportsregulatorysubmissions
8.NovartisremibrutinibPhaseIIItrialsmettheirprimaryendpointsandshowedrapidsymptomcontrolinchronicspontaneousurticaria
文章来源及作者:药智网

 京公网安备 11010802028547号
京公网安备 11010802028547号