
当地时间2024年1月29日,美国生物技术公司 Ascidian Therapeutics 宣布旗下在研RNA外显子编辑疗法ACDN-01的研究性新药(IND)申请获美国食品药品监督管理局(FDA)批准,该候选药物还被授予快速通道资格。
Ascidian新闻稿称,ACDN-01是首个获批进入临床阶段的RNA外显子编辑疗法,并且是首款针对Stargardt病(黄斑萎缩性损害合并视网膜黄色斑点沉着)遗传原因的临床阶段治疗方法。Ascidian预计将于 2024年上半年启动针对Stargardt病和其他ABCA4相关视网膜病变的1/2期临床研究的招募工作。
RNA编辑疗法是一种基于RNA修饰的新兴疗法,通过敲除、替换或抑制突变的RNA片段来达到治疗遗传疾病的目的。
近日获英国、美国等监管机构批准上市的CRISPR/Cas9基因编辑疗法Casgevy属于DNA编辑。相比之下,DNA编辑可一次性、永久性地改变DNA上的基因,RNA编辑不改变基因,而是改变基因的表达。有人将RNA编辑比喻为“纠正文件复印件上的打印错误”,而DNA编辑则是“修改原始文件”。
1月30日,中国科学院脑科学与智能技术卓越创新中心研究员杨辉在接受澎湃科技采访时表示,RNA编辑和DNA编辑最大的区别是前者不改变DNA序列,因此安全性天然比DNA编辑好一些,不过目前ACDN-01的疗效尚待验证。
“大家现在很关注DNA编辑,它的药效很好,但具有脱靶风险,而且监管要求严格。如果RNA编辑能达到和DNA编辑一样的效果,大家可能就会更倾向于RNA编辑疗法的开发。”杨辉说。
灵感源于海鞘的RNA反式剪接
Ascidian的核心技术是RNA反式剪接(trans-splicing),其灵感来源于低等海洋生物海鞘(ascidian),它是脊椎动物的祖先。海鞘也是Ascidian公司的名称来源。
为了从幼虫生长到成虫,海鞘通过RNA反式剪接和选择性剪接重新设计它们的转录组。受此启发,Ascidian公司希望通过RNA反式剪接(trans-splicing)编辑和替换人类突变的外显子,来重写RNA(RewritingRNA),开发出一种全新的治疗方法,从根本上找到解决疾病的方法。
什么是反式剪接?根据中心法则,DNA转录为mRNA,RNA再翻译为蛋白质,进而执行生命活动。在真核生物中,DNA直接转录出来的是前体mRNA(Pre-mRNA),Pre-mRNA要进行剪接,剪除内含子,保留外显子并拼接,形成成熟mRNA。如果外显子中出现突变,就可能导致异常蛋白质产生,形成严重疾病。
Pre-mRNA的剪接通常是顺式剪接(cis-splicing),即在一个Pre-mRNA分子内部发生剪接。反式剪接指两个不同的Pre-mRNA分子之间发生剪接,形成mRNA杂合体。
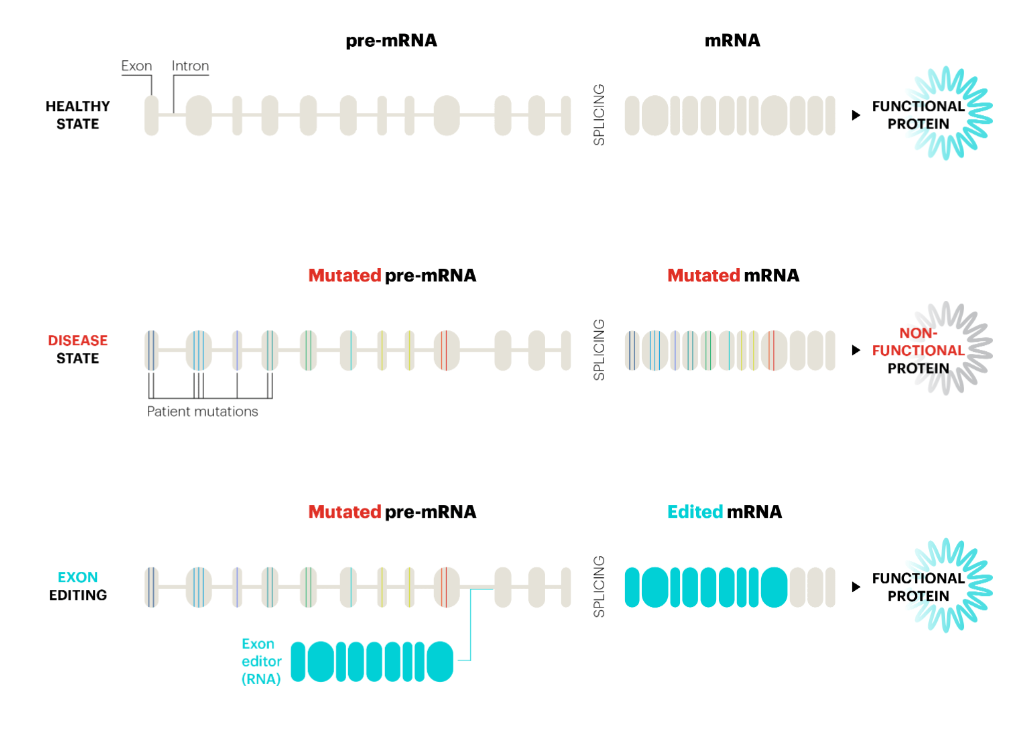 RNA外显子编辑疗法的作用机制。图片来源:Ascidian官网
RNA外显子编辑疗法的作用机制。图片来源:Ascidian官网
Ascidian公司的RNA外显子编辑平台利用反式剪接,将其与RNA合成技术、深度测序技术,以及经过临床验证的递送技术相结合,将两个不同的RNA分子精确拼接在一起,形成正确的成熟mRNA,来实现重写RNA(Rewriting RNA),以恢复正常的蛋白质功能。
与其它只能修改一个RNA碱基的RNA编辑器不同,该技术平台可以替换多个连续的外显子,从而提供更强大和通用的RNA治疗方法。
杨辉向澎湃科技表示,Ascidian公司的RNA编辑技术并非基于CRISPR系统,RNA编辑和DNA编辑最大的区别是前者不改变DNA序列,因此安全性天然比DNA编辑好一些,但有效性可能没有DNA编辑那么强。
“DNA的改变是永久性的改变,RNA的改变是可逆的。一个DNA可以转录成很多个RNA拷贝,假设有10个RNA拷贝,RNA编辑往往只能纠正3-5个拷贝。但如果纠正1个DNA,这10个RNA拷贝就都纠正了。”他解释道。
FDA对两种方法的监管也不同。“FDA一般要求对使用DNA编辑疗法的患者至少随访15年,而对使用RNA编辑疗法的患者的随访时长要求是5年。”杨辉说。
有效性待验证
ACDN-01是一款针对ABCA4基因突变相关视网膜病变的RNA编辑疗法。ABCA4基因突变会导致多种遗传性眼病,包括Stargardt病、视锥视杆细胞营养不良和视网膜色素变性等。
Stargardt病是遗传性黄斑变性的最常见形式。它是一种原发于视网膜色素上皮层的常染色体隐性遗传病,ABCA4基因突变是引发Stargardt病的原因之一,该突变导致进行性视网膜变性和视力丧失,通常始于儿童期及青少年时期。
据医疗保健市场研究和商业咨询公司DelveInsight估计,Stargardt病的患病率为1/10000-1/ 8000,全球约有80万人受此病影响,美国约有30000多名患者。目前,FDA未批准任何治疗Stargardt病的疗法上市。
2023年5月9日,Ascidian研究主管Robert Bell博士在2023年美国基因与细胞治疗学会年会(ASGCT)上展示了ABCA4项目的6个月数据,其中包括 ACDN-01 。该数据表明,使用单个AAV递送的RNA外显子编辑候选药物进行一次性治疗后,非人灵长类动物视网膜细胞恢复了全长ABCA4蛋白表达。
杨辉认为,ACDN-01可覆盖的人群数量不少,但疗效有待验证,“Ascidian在去年的ASGCT上披露了体外的数据,但体内的数据还没有展示。”
Ascidian的RNA编辑疗法是否会影响产业?杨辉认为,最终还是要靠人体临床试验的数据“说话”,“如果人体临床试验的数据好,我觉得会带动一波相关疗法的开发,但如果人体临床试验的数据不好,研究人员则要继续优化RNA反式剪接技术。”
尽管ACDN-01尚处早期阶段,但已吸引业界关注。“大家现在很关注DNA编辑,它的药效很好,但具有脱靶风险,而且监管要求严格。如果RNA编辑能达到和DNA编辑一样的效果,大家可能就会更倾向于RNA编辑疗法的开发。”杨辉告诉澎湃科技。
公开信息显示,总部位于瑞士的罗氏(RHHBY.US)、总部位于美国的礼来(LLY.US)和总部位于英国的葛兰素史克(GSK.US)等跨国药企均在RNA编辑领域有所布局。
2023年12月,美国生物技术公司Wave Life Sciences公司宣布其在研RNA编辑疗法WVE-006在1期临床试验中开始给健康志愿者给药,WVE-006是一种寡核苷酸疗法,旨在治疗与α-1抗胰蛋白酶缺乏症(AATD)相关的肺部或肝脏疾病。葛兰素史克与Wave达成为期4年的研发合作,Wave可能获得高达33亿美元的款项。
在中国,辉大(上海)生物科技有限公司(以下简称“辉大基因”)、博雅辑因(北京)生物科技有限公司(以下简称“博雅辑因”)、时夕(广州)生物科技有限公司和锐正基因(苏州)有限公司等公司正在开发RNA编辑疗法。
2023年9月6日,辉大基因宣布其治疗新生血管性年龄相关性黄斑变性的RNA编辑疗法HG202在研究者发起的临床研究(IIT研究)中完成首例患者给药。2023年10月14日,辉大基因又宣布其RNA编辑疗法HG204获FDA的儿科罕见病资格认定(RPDD),用于治疗罕见且致命的儿童神经发育障碍疾病——MECP2重复综合征(MDS)。
2023年5月3日,博雅辑因宣布在第26届ASGCT年会上,以口头报告形式发布其在研体内RNA编辑疗法在非人灵长类(NHP)模型(包括疾病模型)中的临床前概念验证数据。
文章来源:澎湃新闻
作者:曹年润

 京公网安备 11010802028547号
京公网安备 11010802028547号