医药寒冬下,如何用魔法打败魔法?这家Biotech成功了。
近日,云顶新耀宣布基于未经审计的初步计算,公司预计2023年的总收入达到人民币1.24亿至1.26亿元,该预期较2022年的人民币1280万元收入涨幅接近10倍。
成立仅3年,云顶新耀就在港股IPO上市,而成立6年多,云顶新耀靠2款新药即实现业绩大幅提升。
云顶新耀,还有哪些值得期待?
01
“licensein”密集收获期
云顶新耀是一家以license-in为优势的企业,旗下已打造10余款有潜力成为全球同类领先或同类优先的药物和疫苗组合,2023年,云顶新耀有2个新药相继获批上市(图1)。

图1云顶新耀的两款商业化产品
图片来源:云顶新耀官网
依嘉
是云顶新耀从Tetraphase制药公司(Innoviva,Inc.的全资子公司)授权引进的一种新型、全合成、广谱、含氟四环素类、静脉注射抗菌药物,云顶新耀拥有依嘉在大中华区、韩国和部分东南亚主要市场(包括印度尼西亚、马来西亚、菲律宾、泰国、新加坡和越南)独家权益研发和商业化权益。
2023年3月,依嘉的新药上市申请(NDA)获得NMPA批准,用于治疗成人复杂性腹腔内感染(cIAI),至此,依嘉已在美国、欧盟、英国、新加坡、中国大陆和中国香港等被批准用于治疗cIAI。
随后7月16日,依嘉的首张处方在复旦大学附属华山医院开出,开启商业化之路,成为云顶新耀首款商业化产品。
cIAI是包括腹腔单个脏器感染、腹膜炎以及腹腔脓肿等多个情况在内的腹腔感染性疾病,属于危险性疾病。2018年,中国约有290万cIAI患者,耐药菌导致的感染率不断攀升,限制了现有抗生素使用的有效性。
依嘉是一种潜在同类更新一代新型抗菌药物,用于治疗包括在中国常见的革兰氏阴性菌、革兰氏阳性菌感染在内的多重耐药菌感染的一线经验性单药治疗,成为能够对抗多重耐药菌的高端抗生素,为cIAI患者提供新的选择。
耐赋康
是云顶新耀于2019年6月以总额高达1.2亿美元从CalliditasTherapeutics公司引进的一款肾病药物,云顶新耀拥有耐赋康在中国(含大陆、香港、澳门以及台湾地区)和新加坡的独家开发和商业化权利。
耐赋康于10月28日被中国澳门特别行政区药物监督管理局批准上市,随后11月份被NMPA批准上市,用于治疗有疾病进展风险的原发性IgA肾病成人患者,以降低蛋白尿水平。
此前,耐赋康已于2021年12月和2022年7月分别被美国FDA和欧洲EMA批准上市,是首个同时被FDA、EMA和NMPA批准的靶向IgA肾病源头——肠道黏膜免疫的对因治疗新药,于2020年12月被CDE纳入突破性疗法创新药名单,是中国第一个非肿瘤药物拿到突破性用药的资格。
IgA肾病患者美国十万多人,欧盟20万病人,中国预估有500-800万病人,耐赋康在美国上市约7个月销售额达到1210万美元,2022年第三季度在欧盟额达到1250万欧元,而国内病人基数远远超过美国和欧盟,市场前景广阔[1]。
02
2款NDA产品,
有望短期获批
云顶新耀通过引进和自研在肿瘤、自体免疫性疾病、心肾疾病、感染性和传染性疾病等疾病布局多条管线,其中2款药物有望在今年内获批上市(图2)。

图2云顶新耀的两款NDA产品
图片来源:云顶新耀官网
头孢吡肟-他尼硼巴坦
是云顶新耀与VenatorxPharmaceuticals共同开发的一种β-内酰胺/β-内酰胺酶抑制剂(BL/BLI)抗菌药物,云顶新耀有权在大中华区、韩国、印度尼西亚、马来西亚、菲律宾、泰国、新加坡和越南进行头孢吡肟-他尼硼巴坦的开发和商业化活动。
2023年8月份,头孢吡肟-他尼硼巴坦的NDA被FDA接受并授予优先审评,PDUFA日期为2024年2月22日,此前,FDA此前已授予头孢吡肟-他尼硼巴坦"合格治疗感染病产品"和"快速通道"资格。
此次NDA得到了关键性3期研究CERTAIN-1的研究结果的支持,该研究评估了头孢吡肟-塔尼硼巴坦与美罗培南相比在成人复杂性尿路感染(cUTI)患者(包括急性肾盂肾炎)中的疗效和安全性。
研究结果显示:头孢吡肟-他尼硼巴坦在微生物治疗意向(microITT)人群中治愈测试访视(第19-23天)中复合微生物学和临床成功的主要疗效终点优于美罗培南。头孢吡肟-他尼硼巴坦耐受性良好,未发现新的安全性发现[2]。
随后9月份,云顶新耀宣布CDE拟将注射用头孢吡肟-他尼硼巴坦纳入优先审评,用于治疗成人复杂性尿路感染。
Etrasimod
最初是由ArenaPharmaceuticals开发的一款每日一次口服的选择性鞘氨醇-1-磷酸(S1P)受体调节剂,2021年,辉瑞以67亿美元现金收购Arena,而云顶新耀于2017年从Arena获得了在大中华区和韩国开发、生产和商业化etrasimod的独家权利。
2023年10月13日,辉瑞宣布FDA已批准Etrasimod的NDA,用于治疗中度至重度活动期溃疡性结肠炎(UC)的成人患者。
此次批准是基于ELEVATEUC的3期注册项目(ELEVATEUC52和ELEVATEUC12)的结果,该项目评估了Etrasimod2mg每日一次对既往对至少一种常规、生物制剂或JAK抑制剂治疗失败或不耐受的UC患者临床缓解的安全性和有效性。
研究结果表明:在ELEVATEUC52试验中,接受Etrasimod治疗的患者在第12周时的临床缓解率为27.0%,而接受安慰剂治疗的患者为7.0%,第52周时为32.0%,而接受安慰剂治疗的患者为7.0%。在ELEVATEUC12试验中,接受Etrasimod治疗的患者中有26.0%达到临床缓解,而接受安慰剂治疗的患者为15.0%。在第12周达到所有关键的次要疗效终点,包括内窥镜改善和粘膜愈合[3]。
03
自主+授权,
临床多条管线齐发
除此之外,云顶新耀还有很多临床在研和临床前产品,如治疗狼疮性肾炎的Zetomipzomib、治疗肾病的BTK抑制剂EVER001、治疗狂犬病的mRNA狂犬疫苗和预防多个传染性疾病的mRNA预防性疫苗等(图3)。
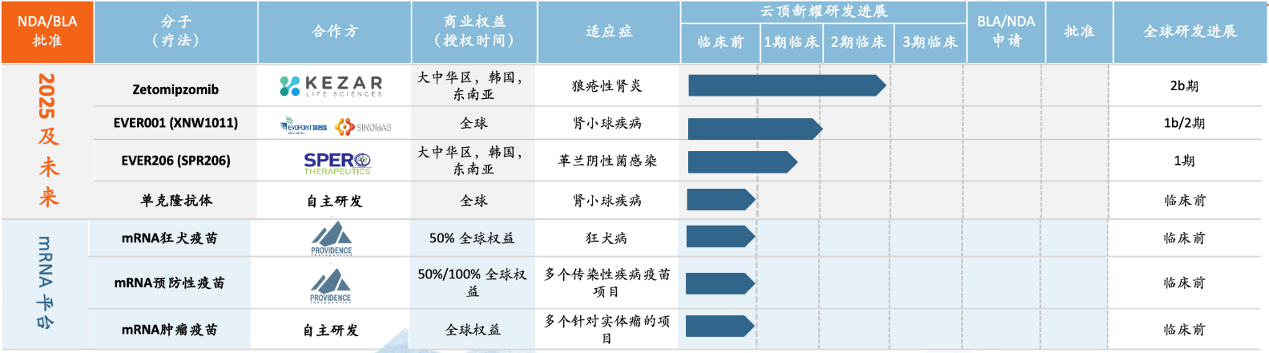
图3云顶新耀部分研发管线
图片来源:云顶新耀官网
Zetomipzomib
是云顶新耀于2023年9月份以700万美元的预付款以及最高为1.255亿美元的临床和商业里程碑付款从KezarLifeSciences引进的一款新型、同类首创、选择性免疫蛋白酶体抑制剂,云顶新耀拥有Zetomipzomib在大中华区、韩国和部分东南亚国家的临床开发和商业化权益。
云顶新耀和Kezar共同推进Zetomipzomib的全球2b期PALIZADE临床研究,以评估两种剂量水平的zetomipzomib在活动性狼疮性肾炎患者中的疗效和安全性。
2023年12月份,云顶新耀宣布NMPA已受理zetomipzomib在中国的新药临床试验(IND)申请。
目前全球共有6款BTK抑制剂获批上市,历经三代,用于治疗血液瘤。现在很多药企在开发BTK抑制剂在自免领域的应用,如诺华的用于治疗慢性自发性荨麻疹的Remibrutinib等。
EVER001
是云顶新耀引进的一款新一代共价可逆的BTK抑制剂,正在全球范围内开发用于治疗肾病,并与中国抗体联合开展自身免疫疾病的临床研究。
2021年9月,云顶新耀与信诺维、中国抗体达成总额超5.6亿美元的合作,获得EVER001的开发、生产制造和商业化的全球权益。
2022年9月26日,云顶新耀宣布CDE批准了EVER001胶囊用于治疗肾小球疾病的Ib期临床试验(IND)申请。该Ib期临床研究将用于评价EVER001在蛋白尿为特征的肾小球疾病的中国患者中的安全性、疗效、药代动力学和药效学。
云顶新耀是一家非常有眼光的“licensein”企业,如上述在辉瑞收购Arena之前引荐Etrasimod的大中华等区域权益,在吉利德收购Immunomedics之前引进Trodelvy的亚洲权益,后于2022年又以总额高达4.55亿美元转让该权益给吉利德。
在新冠使得mRNA疫苗火之前,云顶新耀已于2021年9月与加拿大ProvidenceTherapeutics签订战略合作协议,以共同推进mRNA疫苗及疗法的研发,由此可见他们的前瞻性和远见性。
根据协议条款,云顶新耀拥有在大中华区和12个东南亚国家获得Providence的mRNA新冠候选疫苗的研发、生产和销售权利。
虽如此,但云顶新耀不满足于“licensein”,也在积极自主研发新的产品,如布局肾病和mRNA平台领域新型药物,目前都处于早期开发阶段。
04
结语
云顶新耀成功实现商业化,营收大幅上涨,在抗感染领域和肾病领域有多条管线布局,未来通过自主研发和授权引进继续加强公司管线发展。
参考文献
1.范俊青的雪球专栏:云顶新耀的Nefecon在中国的巨大市场
2.VenatorxPharmaceuticalsAnnouncesFDAAcceptanceandPriorityReviewofNewDrugApplicationforCefepime-TaniborbactamtoTreatComplicatedUrinaryTractInfections(cUTI),includingPyelonephritis,inAdults
3.U.S.FDAApprovesPfizer’sVELSIPITY™forAdultswithModeratelytoSeverelyActiveUlcerativeColitis(UC)
来源:药智网 作者:抒扬

 京公网安备 11010802028547号
京公网安备 11010802028547号