
小核酸药物领域开年迎喜讯。
瑞博生物成立于2007年,致力于开发RNA干扰(RNAi)药物,目前有8款小核酸药物进入临床,在研管线涵盖了慢性疾病、肿瘤、炎症、眼科领域,其中5款基于自主研发的GalNAc(N-乙酰半乳糖胺,目前最常见的偶联系统)小核酸药物递送技术平台RIBO-GalSTARTM,该平台高度特异肝靶向具有高效和长效特征。
肝病领域的RBD1016的乙肝和丙肝两项适应症分别进入全球临床的2期和1期。此外,瑞博还有一款靶向Caspases 2视神经保护的siRNA药物RBD1007,在研适应症非动脉炎性前部缺血性视神经病变(NAION)已处于临床3期。
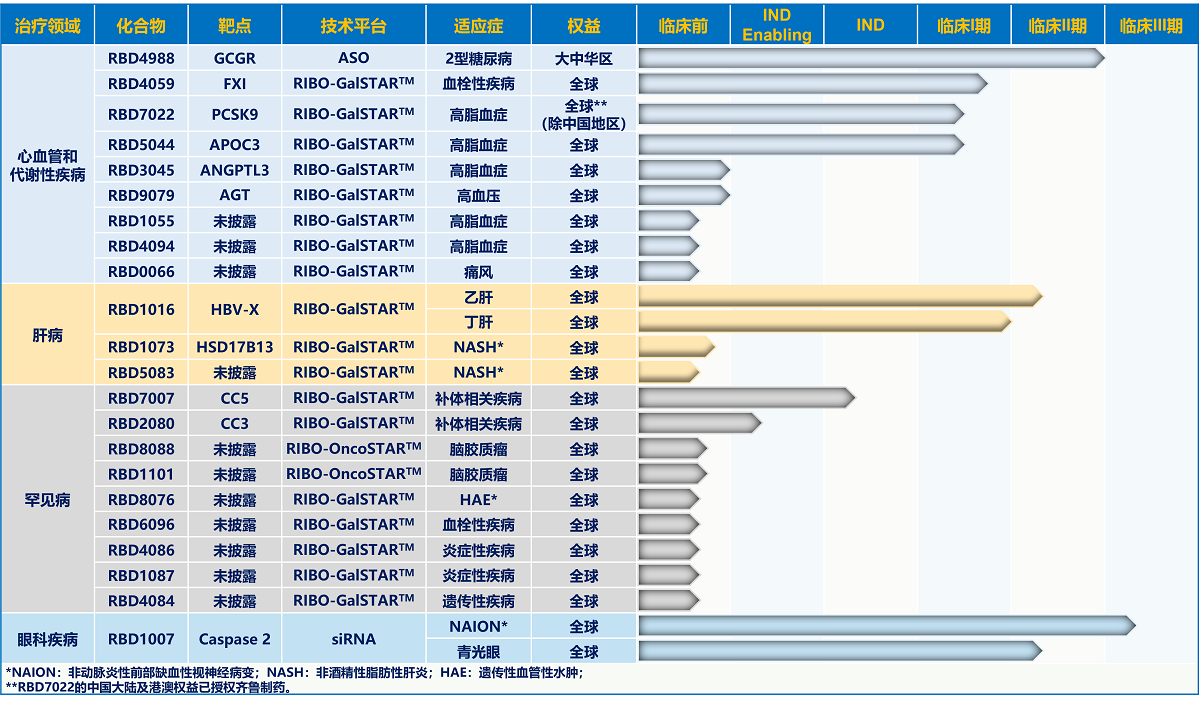
图1 瑞博生物的在研管线
图片来源:瑞博生物公司官网
舶望制药成立于2021年4月,专注于siRNA药物的开发,成立不到三年来已经建立起多个技术平台和丰富的研发管线,在心血管疾病、罕见病、病毒感染、代谢疾病和中枢神经系统疾病领域都建立有产品管线。
心血管领域的BW-01、BW-02已经进入临床阶段,大概率为此次授权诺华的核心产品。根据申报信息,这两款心血管产品分别用于治疗血脂异常和高血压。
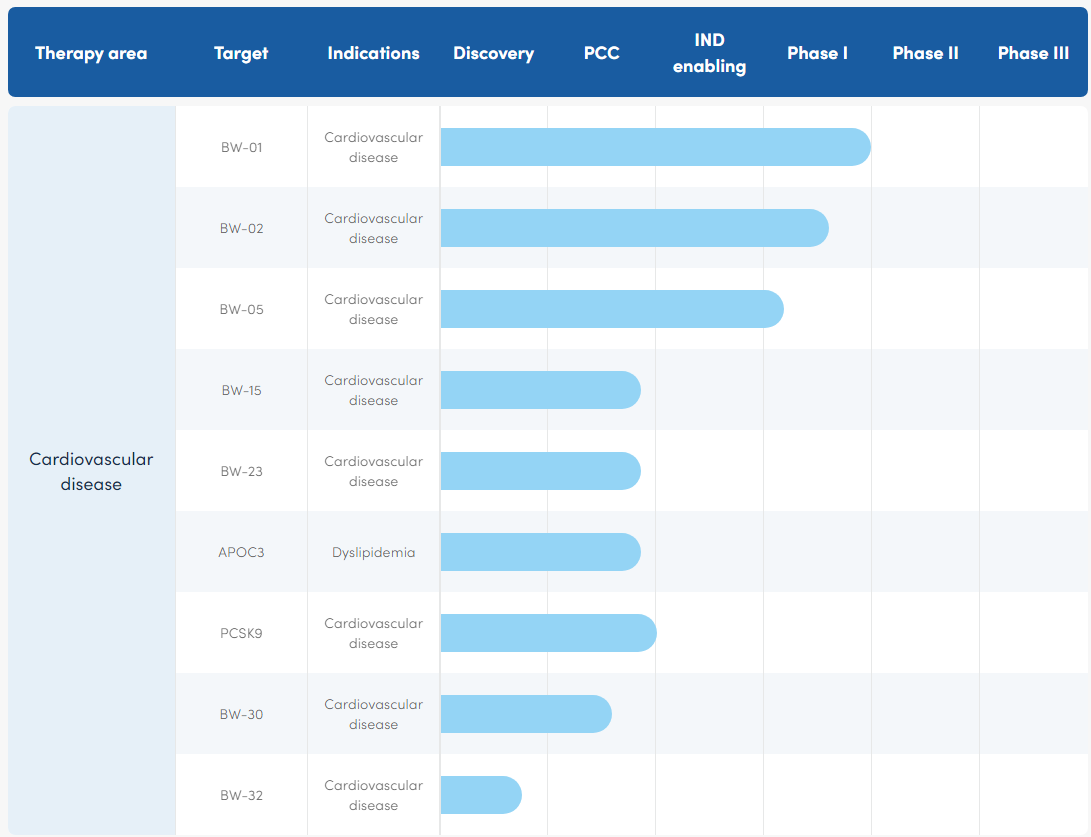
图2 舶望制药心血管领域在研管线
图片来源:舶望制药公司官网
小核酸药物的优势
RNA疗法主要分为mRNA疗法和寡核苷酸药物(小核酸)两大类。
小核酸药物通常为几十个碱基对长度的单链/双链的DNA或RNA,主要通过碱基配对的方式作用于细胞内的mRNA,通过调控蛋白质的表达,实现治疗疾病的目的。与传统化药,生物药相比,小核酸药物具备诸多优势:
RNA能够与三种主要形式的生物大分子(DNA、RNA和蛋白质)相互作用,所以基于RNA药物的最大优势之一就是他们能够靶向细胞内几乎所有遗传成分,这使得RNA疗法可扩大可成药靶点的范围,包括传统蛋白质和以前未成药或“不可成药”的转录物和基因。
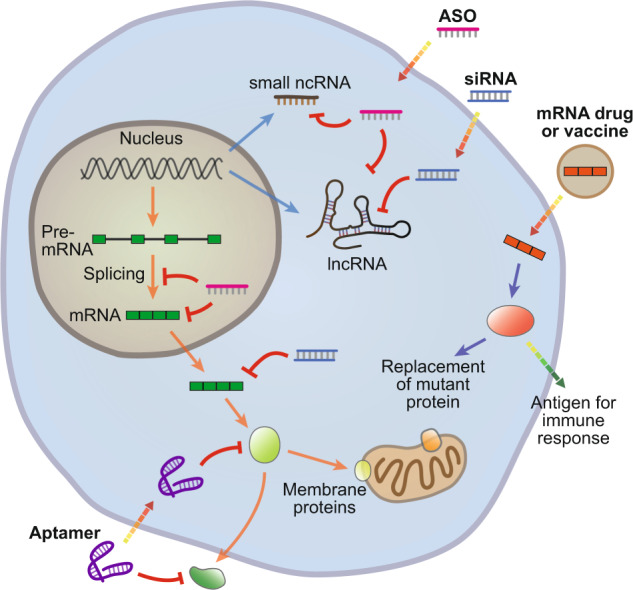
图3 RNA疗法可以靶向多种细胞分子
图片来源:参考资料3
小分子或者抗体药物的开发过程需要数年时间,对RNA药物一旦确定了RNA的化学结构和进入体内的递送方式,就可以快速设计和合成基于RNA的药物用于临床测试。
天然RNA很容易被核酸酶降解,在对其合成进行各种修饰之后,RNA的稳定性大大增加。例如,诺华2021年上市靶向PCSK9的降脂siRNA疗法Leqvio,在一次注射后降脂效果可以持续6个月以上,显著增加了给药间隔时间。
由于罕见病药物的研发无法保证利润,因此制药公司生产治疗罕见性疾病的积极性不高。基于RNA药物而言,一旦RNA的化学性质及其递送系统得到优化,开发这类药物的成本就会大大降低。个性化RNA药物为非常罕见的疾病提供高效治疗的可能性。
与基因疗法相比,RNA疗法没有显著的遗传毒性。在基因疗法中,使用病毒载体将DNA分子递送至细胞,该载体有可能整合到基因组并引起突变,使用RNA可以避免这种潜在风险。
小核酸药物分子量小、靶点多、半衰期长、生产成本低等优势加持下,使小核酸药物的研发成功率更高。以开发RNA疗法的Alnylam公司为例,2012年至2022年间,在公司RNAi平台下靶向生物标志物的疗法中,1期、2期、3期临床成功率分别为86.7%、81.8%和87.5%,都超过80%,新药开发的临床阶段综合成功率高达62%。
小核酸药物觉醒
目前已获批的小核酸药物按照作用机制大致分为:反义寡核苷酸(ASO)、剪接转换寡核苷酸(SSO)、RNA干扰(RNAi)和针对蛋白质的RNA适配体,目前小核酸药物的研究主要集中在ASO和RNA干扰中的siRNA。
截至2023年末,全球已有19款小核酸药物获批上市,治疗领域主要集中在DMD、罕见的血脂异常、SMA、ALS等罕见病领域。
1998年至2022年全球总共批准了核酸药物18款,其中3款RNA疫苗获批上市,其中两款新冠疫苗COMIRNATY和SPIKEVAX,还有一款乙肝疫苗Heplisav–B,其余15款为小核酸药物,包括ASO和SSO总计有9款药物,5款SiRNA药物,和1款核酸适配体药物。
其中Vitravene、Macugen和Kynamro已退市,在售产品见图4。
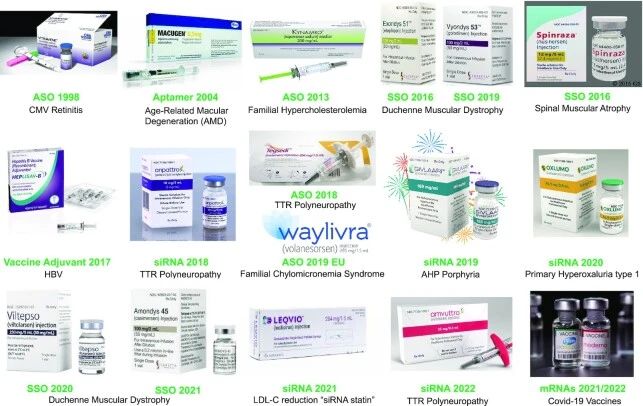
图4 1998年至2022年批准的小核酸药物和mRNA疫苗、批准年份以及适应症
图片来源:参考资料4
2023年,FDA又批准了4款小核酸药物上市,分别是渤健/Ionis的TOFERSEN(肌萎缩侧索硬化),阿斯利康/Ionis的EPLONTERSEN(多发性神经病)、诺和诺德的NEDOSIRAN SODIUM(1型原发性高草酸尿症)、安斯泰来的AVACINCAPTAD PEGOL SODIUM(年龄性相关性黄斑变性引起的地图样萎缩)。
挑战和发展并存
小核酸药物也曾受限于核酸递送技术,发展坎坷;2010年前后,由于受限于递送系统,小核酸药物的研发屡遭挫折。
2010年罗氏终止在德国和美国的RNAi研究,2011年辉瑞和Abbott砍掉了RNAi药物研发项目;2011年MSD关停了旧金山的RNAi药物研发中心,2014年将Sirna以1.75亿美元的低价卖给Alnylam。2011年,诺华终止了与Alnylam的5年合作关系,2014年大幅缩减RNAi的投入,并停止了波士顿RNAi业务。
小核酸药物需要进入人体细胞内发挥作用,从体外递送到细胞内这一过程需要克服稳定性、免疫原性、跨膜转运和内吞体逃逸等,即亲和力之外,还需要克服化学稳定性、对细胞外切和内切核酸酶降解的抵抗力,即代谢稳定性、靶位点可及性、递送和生物分布,与蛋白质和受体的结合、药代动力学和药效学以及毒性和补体激活等技术难题。目前主要是通过对核苷酸进行化学修饰来提高底物特异性、增强对核酸酶稳定性以及降低免疫原性,修饰的手段包括对核糖、磷酸骨架、碱基以及核酸链末端等进行改进。
第一代方法主要是利用硫代磷酸盐进行主链修饰,可通过增加疏水性、对内切酶的抗性等来促进体内细胞摄取、提高生物利用度。
第二代修饰方法是在核糖上2,位的修饰,包括2’-氟、2’-甲氧基等,可以提高对RNA的结合亲和力并进一步提升核酸酶抗性。
构象上受限制的DNA类似物锁核酸和三环DNA(tcDNA)可以使其具有更强的亲和力。
第三代修饰则是核糖的五元环改造,包括使用PNA、PMO等可以进一步增强核酸药物对核酸酶的抗性、提高亲和力和特异性。
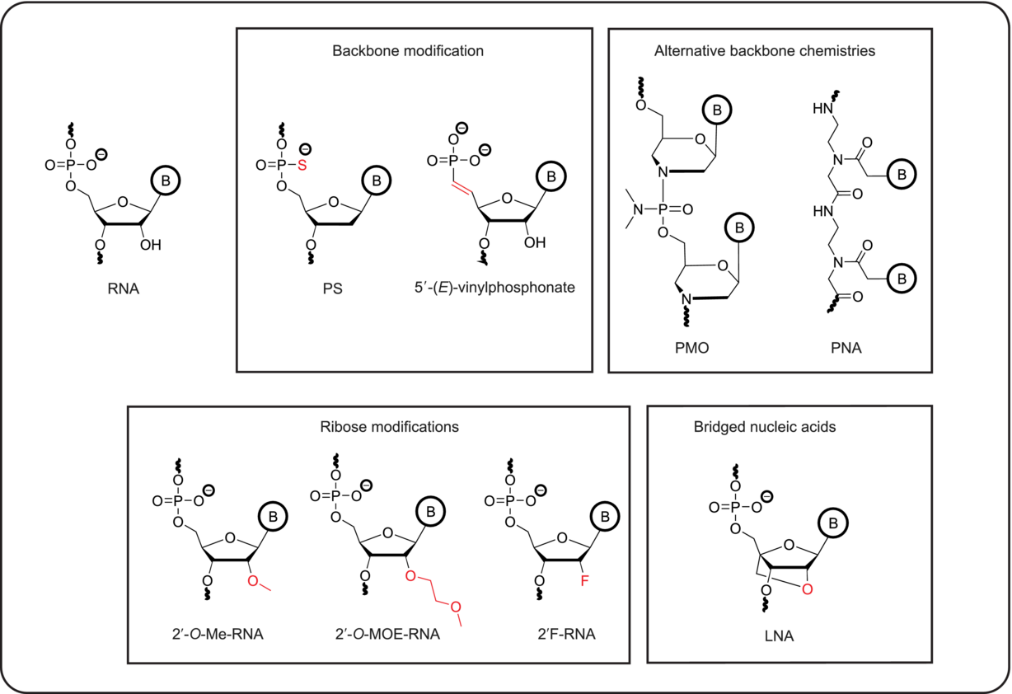
图5常见的RNA化学修饰
图片来源:参考资料2
化学修饰可以提高小核酸药物对核酸酶的抗性、降低免疫原性和增强亲和力。但是小核酸药物需要进入细胞内才能发挥作用。细胞对小核酸药物的摄取主要是通过不同类型的内吞作用,小核酸药物在随后进入内溶酶体系统,需要进行内体逃逸来避免在溶酶体环境中降解,只有很小部分小核酸药物能够逃出内体,并顺利发挥作用。ASO由于分子量相对较小,可能不带电并有一定的疏水性,可以在不需要递送剂的情况下有效地进入细胞并逃逸到细胞质和细胞核,不过这时往往需要较高的药物剂量。对于双链siRNA药物,由于体积太大,带负电荷,无法在没有递送系统的情况下进入细胞,因此递送系统的优化和改进可以提升小核酸药物的实用性。
目前的递送系统有病毒载体和非病毒载体,病毒载体多应用于基因治疗,小核酸药物非病毒载体应用相对更多,非病毒载体又可以分为两类:与载体直接共轭相连和以纳米颗粒载体递送。
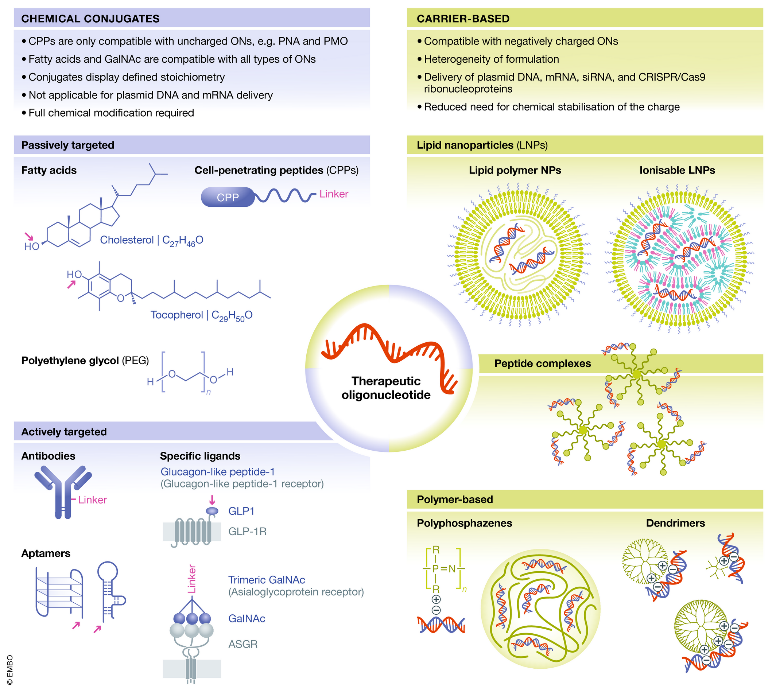
图6治疗性寡核苷酸递送系统,化学缀合物(图左)和纳米颗粒载体(图右)
图片来源:参考资料1
聚合物、细胞穿透肽(CPPs)和脂质可以与小核酸药物共价结合以实现被动靶向,而小核酸药物与抗体、受体配体和适配体的共价结合则适用于主动靶向。
纳米颗粒载体可用于封装带负电荷的小核酸药物,可以基于脂质,如脂质纳米颗粒(LNPs)和外泌体;可以基于聚合物,如树枝状聚合物和聚磷脂等;也可以基于肽或者由几种不同类型的化合物组成的混合系统。
CPP只与不带电的小核酸药物兼容,如PMO和PAN,脂质体和GalNAc则与所有类型的小核酸药物兼容。
小 结
小核酸药物在近几年取得了长足进步,但是对内吞进入细胞的小核酸药物来说经过内体逃逸进入细胞质才能发挥作用,研究表明通过内吞作用的小核酸内体逃逸率不足0.01%。因此解决内体逃逸仍是小核酸药物递送中需要解决的问题。此外大多数药物以肝脏为目标,无特异性地输送到全身,还需要进一步的技术突破来增强组织特异性递送;因为大多数的治疗针对罕见病,临床数据有限,随着高血脂、脂肪肝炎等常见疾病药物的出现,这种情况可能会改变。
展望未来,RNA医学领域的发展,必将会对患者带来巨大的好处。
参考资料:
文章来源及作者:药智头条

 京公网安备 11010802028547号
京公网安备 11010802028547号